题目内容
8.H2SO3 为二元弱酸,常温下,对于pH=5的NaHSO3溶液的下列说法正确的是( )| A. | c(H2SO3)>c(SO32-) | |
| B. | 溶液中HSO3-电离程度大于水解程度 | |
| C. | 水电离出c(H+)=10-5mol•L-1 | |
| D. | c(Na+ )+c(H+)=c(HSO3-)+c(OH-)+c(SO32-) |
分析 NaHSO3溶液的pH=5,说明HSO3-的电离程度大于其水解程度,溶液显示酸性,则:c(H2SO3)<c(SO32-);酸溶液中的氢氧根离子是水电离的,则pH=5的NaHSO3溶液中水电离的氢离子浓度为10-9mol•L-1;亚硫酸氢钠溶液中满足电荷守恒:c(Na+ )+c(H+)=c(HSO3-)+c(OH-)+2c(SO32-),据此对各选项进行判断.
解答 解:A.NaHSO3溶液的pH=5,说明HSO3-的电离程度大于其水解程度,则:c(H2SO3)<c(SO32-),故A错误;
B.NaHSO3溶液的pH=5,溶液显示酸性,说明HSO3-的电离程度大于其水解程度,故B正确;
C.pH=5的NaHSO3溶液中的氢氧根离子是水电离的,则水电离的氢离子浓度为:10-9mol•L-1,故C错误;
D.亚硫酸氢钠溶液中满足电荷守恒:c(Na+ )+c(H+)=c(HSO3-)+c(OH-)+2c(SO32-),故D错误;
故选B.
点评 本题考查了弱电解质的电离、离子浓度大小比较,题目难度中等,根据亚硫酸氢钠溶液的pH=5得出HSO3-的电离程度大于其水解程度为解答关键,注意掌握电荷守恒、物料守恒及盐的水解原理在判断离子浓度大小中的应用.

练习册系列答案
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案
相关题目
18.下列溶液中粒子的物质的量浓度关系正确是( )
| A. | 室温下pH=2的醋酸与pH=12的NaOH溶液等体积混合,所得溶液中:c(Na+)>c(OH)>c(CH3COO-)>c(H+) | |
| B. | 含KI、KCl均为0.1mol•L-1的混合溶液10mL与20mL0.1mol.L-1AgNO3溶液混合,所得悬浊液中:c(K+)═c(NO3-)>c(Ag+)>c(Cl-)>c(I-) | |
| C. | 室温下,向10mL0.1mol•L-1的氨水中滴加同体积同浓度的CH3COOH的溶液,在滴加过程中:$\frac{c(N{{H}_{4}}^{+)}}{c(N{H}_{3}•{H}_{2}O)}$先增大再减小 | |
| D. | CH3COONa和CaCl2混合溶液中:c(Na+)+c(Ca2+)═c(CH3COO-)+(CH3COOH)+2c(Cl-) |
19.高温下,某反应达平衡,平衡常数K=$\frac{c(CO)•c({H}_{2}O)}{c({C}_{2}O)•c({H}_{2})}$,恒容时,温度升高,H2浓度减小.下列说法正确( )
| A. | 升高温度,逆反应速率减小 | |
| B. | 恒温恒容下,增大压强,H2浓度一定减小 | |
| C. | 该反应的焓变为正值 | |
| D. | 该反应化学方程式为CO+H2O═CO2+H2 |
16.下列关于${\;}_{27}^{60}$Co原子的叙述不正确的是( )
| A. | 中子数为33 | B. | 电子数为33 | C. | 质量数为60 | D. | 质子数为27 |
13.对于可逆反应2SO2+O2?2SO3,在混合气体中充入一定量的18O2,足够长的时间18O原子( )
| A. | 存在于O2、SO2和SO3中 | B. | 只存在于O2和SO3中 | ||
| C. | 只存在于O2和SO2中 | D. | 只存在于O2中 |
18.部分短周期元素的原子结构及相关性质如表所示:
请回答:
(1)T在元素周期表中的位置为第三周期第ⅥA族.
(2)X的一种同位素可用于测定文物年代,该同位素为614C(用原子符号表示).
(3)Z单质的电子式为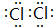 ;Y的氢化物的水溶液显碱性的原因为NH3+H2O?NH3•H2O?NH4++OH-(用离子方程式表示).
;Y的氢化物的水溶液显碱性的原因为NH3+H2O?NH3•H2O?NH4++OH-(用离子方程式表示).
(4)Z与T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是d(填选项字母)
a.常温下,Z单质为气体,T单质为固体
b.Z的氢化物的水溶液的酸性比T强
c.Z的最高正价比Y高
d.最高价氧化物对应水化物的酸性Z比T强
(5)Z的氢化物与Y的氢化物发生化合反应,产物中含有的化学键类型为离子键、共价键.
| 元素编号 | 元素性质或原子结构 |
| T | 最高正价与最低负价的代数和为4 |
| X | 最外层电子数是次电子数次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物的水溶液呈碱性 |
| Z | 最高正价是+7价 |
(1)T在元素周期表中的位置为第三周期第ⅥA族.
(2)X的一种同位素可用于测定文物年代,该同位素为614C(用原子符号表示).
(3)Z单质的电子式为
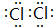 ;Y的氢化物的水溶液显碱性的原因为NH3+H2O?NH3•H2O?NH4++OH-(用离子方程式表示).
;Y的氢化物的水溶液显碱性的原因为NH3+H2O?NH3•H2O?NH4++OH-(用离子方程式表示).(4)Z与T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是d(填选项字母)
a.常温下,Z单质为气体,T单质为固体
b.Z的氢化物的水溶液的酸性比T强
c.Z的最高正价比Y高
d.最高价氧化物对应水化物的酸性Z比T强
(5)Z的氢化物与Y的氢化物发生化合反应,产物中含有的化学键类型为离子键、共价键.
 .
.