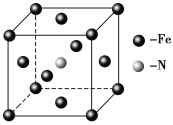
��Ŀ����
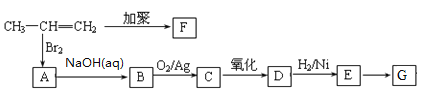
����Ŀ��һ�������£���CO2��H2�Ʊ��״��Ĺ����к������з�Ӧ��
��Ӧ1:CO2(g)��H2(g)![]() CO(g)��H2O(g) ��H1
CO(g)��H2O(g) ��H1
��Ӧ2:CO(g)��2H2(g)![]() CH3OH(g) ��H2
CH3OH(g) ��H2
��Ӧ3:CO2(g)��3H2(g)![]() CH3OH(g)��H2O(g) ��H3
CH3OH(g)��H2O(g) ��H3
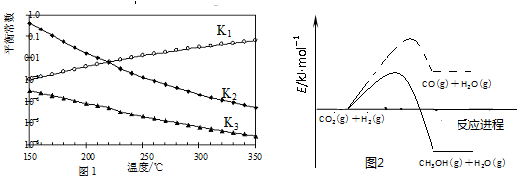
���Ӧ��ƽ�ⳣ���ֱ�ΪK1��K2��K3���������¶ȱ仯��������ͼl��ʾ����Ӧ1��3�Ļ����ͼ2��ʾ��
��1������H2________��H3(����������������������������)��������________��
��2����Ӧ1����S1______0(�������)��ָ���������Է����е��¶�����____(�����ϸ��¶��������ϵ��¶���)
��3���������Ϊ1:1��H2��CO2�����ݻ��ɱ��ܱ������ڣ���ֻ���з�Ӧ1�����д�ʩ����ʹƽ��ʱ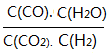 �������____________(�����)
�������____________(�����)
A�������¶�B������ѹǿC������һ������CO2 D���ټ���һ��������
��4��Ϊ�����CO2��H2�Ʊ��״�����Ч�ʺͲ�������ҵ������ͨ����ȡ����ʩ��____________
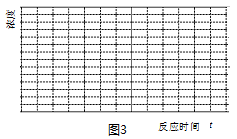
��5�����¶�Ϊ300��ʱ��ʹ���������������Ϊ��H2��CO2������㶨���ܱ������ڽ��з�Ӧ�����¶��·�Ӧ2���г̶Ⱥ�С�ɿ��ɲ����У�����ͼ3�л���CO��CH3OHŨ����ʱ��仯��ƽ��Ķ�������ͼ��
���𰸡���1��С�ڣ���ͼl��֪�������¶����ߣ�K1��������H1��0�����ݸ�˹���ɵ���H3����H1����H2��������H2����H3
��2�������ϸ��¶�
��3��A
��4��ʹ�ô�������ѹ��������Һ�����롢ԭ����ѭ������(���2�㼴��)
��5��
��������
�����������1����ͼl��֪�������¶����ߣ�K1������Ӧ1:CO2(g)+H2(g)![]() CO(g)+H2O(g)��H1��0����Ӧ3�ɷ�Ӧ1+2���ã����ݸ�˹���ɣ���H3=��H1+��H2��������H2����H3���ʴ�Ϊ��С�ڣ���ͼl��֪�������¶����ߣ�K1��������H1��0�����ݸ�˹�����ֵ���H3=��H1+��H2��������H2����H3��
CO(g)+H2O(g)��H1��0����Ӧ3�ɷ�Ӧ1+2���ã����ݸ�˹���ɣ���H3=��H1+��H2��������H2����H3���ʴ�Ϊ��С�ڣ���ͼl��֪�������¶����ߣ�K1��������H1��0�����ݸ�˹�����ֵ���H3=��H1+��H2��������H2����H3��
��2��������G=��H�CT��S����H��0���÷�Ӧ�ܹ�����������S��0�������ܷ�����Ҫʹ�÷�Ӧ�Է�������G��0�����T��ϸ��¶ȣ��ʴ�Ϊ�������ϸ��¶ȣ�
��3��A�������¶ȣ�ƽ�������ƶ���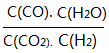 ������ȷ��B������ѹǿ��ƽ�ⲻ�ƶ���
������ȷ��B������ѹǿ��ƽ�ⲻ�ƶ���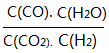 ���䣬����C������һ������CO2�����¶Ȳ��䣬
���䣬����C������һ������CO2�����¶Ȳ��䣬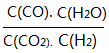 =K�����䣬����D���ټ���һ�������ۣ�ƽ�ⲻ�ƶ���
=K�����䣬����D���ټ���һ�������ۣ�ƽ�ⲻ�ƶ���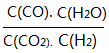 ���䣬����ѡA��
���䣬����ѡA��
��4��Ϊ�����CO2��H2�Ʊ��״�����Ч�ʺͲ�������ҵ������ͨ����ȡ����ʩ��ʹ�ô�������ѹ��������Һ�����롢ԭ����ѭ�����õȷ������ʴ�Ϊ��ʹ�ô�������ѹ��������Һ�����롢ԭ����ѭ�����õȣ�
��5�����¶�Ϊ300��ʱ��ʹ���������������Ϊ��H2��CO2������㶨���ܱ������ڽ��з�Ӧ�����¶��·�Ӧ2���г̶Ⱥ�С�ɿ��ɲ����У����ŷ�Ӧ�Ľ��У���Ӧ1�У�CO��Ũ��������Ӧ3��CH3OH��Ũ��������Ӧ1Ϊ���ȷ�Ӧ����Ӧ3Ϊ���ȷ�Ӧ����Ӧ���е�һ���̶ȣ���Ӧ3 �����ƶ���CH3OH��Ũ����С�����ﵽƽ�⣬CO��CH3OHŨ����ʱ��仯��ƽ��Ķ�������ͼΪ�� ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��

 �㾦�½̲�ȫ�ܽ��ϵ�д�
�㾦�½̲�ȫ�ܽ��ϵ�д� Сѧ�̲���ȫ���ϵ�д�
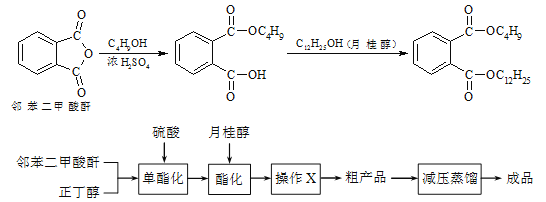
Сѧ�̲���ȫ���ϵ�д�����Ŀ���ڱ������ᶡ���¹�����һ�ֵ���ɫ����״Һ�壬�ܶ�Լ0.97g/cm3��������������ϩ����֬�����ܼ�����ҵ������ԭ�������������£�
�й����ʵ��������ʼ��±���
������ | �ܽ��� | �۵� | �е� |
�ڱ��������� | ������ˮ�����ѣ��������ȱ����Ҵ������� | 131.6�� | 295�� |
������ | ����ˮ�������Ҵ����ѡ������л��ܼ� | -88.9�� | 117.5�� |
�¹� | ������ˮ�����ڴ����� | 24 | 259�� |
�ڱ������ᶡ���¹��� | ������ˮ�����ڶ����л��ܼ� | ���� | 202��210�� |
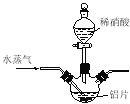
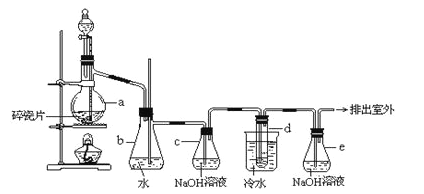
ijʵ��С���ͬѧģ�ҵ�����Ĺ������̣�����ͼ��ʾװ����ȡ�����ڱ������ᶡ���¹�����ͼ�мгֺͼ���װ������ȥ����Ҫ�����������£�
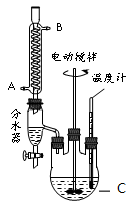
����������ƿ�ڼ���30 g �ڱ�����������16 g �������Լ�����Ũ���ᡣ
�����裬������105 �����������跴Ӧ1Сʱ��
����ȴ�����£�����40 g �¹�������160 �������衢��������Ӧ������
����ȴ�����£�����Ӧ����ﵹ����
��ͨ�����������еIJ���X���õ��ֲ�Ʒ��
��ش��������⣺
��1������C������___________������������ˮӦ��___________����
��2����������жϷ�Ӧ�ѽ����ķ�����___________��
��3��������в���X�ɳ�ȥ����δ��Ӧ���ڱ�����������������������X����___________��
��4�����������м�ѹ�����Ŀ����___________��
��5��ʵ������������ڡ��۲��ʶ��Ƚϸߣ�ԭ����___________��