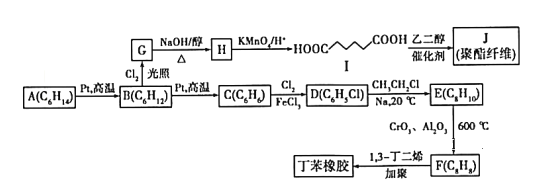
��Ŀ����
����Ŀ����֪��2NO2(g)+CH4(g)![]() N2(g)+CO2(g)g+2H2O(g) ��H�����ݻ�Ϊ2 L�ĺ����ܱ������У�����NO2��CH4�Ļ������0.3 mol��ַ�Ӧ����ͬͶ�ϱ�ʱ��NO2��ƽ��ת�������¶ȵĹ�ϵ��ͼ��ʾ��[Ͷ�ϱ�X=
N2(g)+CO2(g)g+2H2O(g) ��H�����ݻ�Ϊ2 L�ĺ����ܱ������У�����NO2��CH4�Ļ������0.3 mol��ַ�Ӧ����ͬͶ�ϱ�ʱ��NO2��ƽ��ת�������¶ȵĹ�ϵ��ͼ��ʾ��[Ͷ�ϱ�X=![]() ]������˵������ȷ����
]������˵������ȷ����

A.��H<0
B.X>2
C.400Kʱ����Ӧ��ƽ�ⳣ��Ϊ5��10-2
D.Ͷ�ϱ�Ϊ2ʱ��Q��v��(CH4)С��P���v��(CH4)
���𰸡�C
��������
A���¶�����NO2��ƽ��ת���ʼ�С���������»�ѧƽ�������ȷ�Ӧ������У�����Ϊ���ȷ�Ӧ����˸÷�Ӧ������ӦΪ���ȷ�Ӧ����H<0��A��ȷ��
B�����ַ�Ӧ������һ�ַ�Ӧ���Ũ�ȣ��������һ�ַ�Ӧ���ת���ʣ��������ʱ�����ת���ʼ�С����ͬ�¶���Ͷ�ϱ�Ϊ2ʱ����������ת���ʴ���Ͷ�ϱ�ΪXʱ�Ķ�������ƽ��ת���ʣ�˵��X>2��B��ȷ��
C�����ݻ�Ϊ2 L�ĺ����ܱ������У�����NO2��CH4�Ļ������0.3 mol��ַ�Ӧ��400��CͶ�ϱ�Ϊ2ʱ�����������Ϊ0.2 mol������Ϊ0.1 mol����������ƽ��ת����50%����Ӧ��NO2�����ʵ�����0.1 mol���ı�Ũ��Ϊ��c(NO2)=![]() =0.05mol/L�����ݷ���ʽ�����ʷ�Ӧת����ϵ��֪��ƽ��ʱc(NO2)=
=0.05mol/L�����ݷ���ʽ�����ʷ�Ӧת����ϵ��֪��ƽ��ʱc(NO2)=![]() =0.05mol/L��c(CH4)=
=0.05mol/L��c(CH4)=![]() c(NO2)=0.025 mol/L��c(N2)=c(CO2)=
c(NO2)=0.025 mol/L��c(N2)=c(CO2)=![]() ��c(NO2)= 0.025 mol/L��c(H2O)=��c(NO2)= 0.05 mol/L�����Ի�ѧƽ�ⳣ��K=
��c(NO2)= 0.025 mol/L��c(H2O)=��c(NO2)= 0.05 mol/L�����Ի�ѧƽ�ⳣ��K=![]() =0.025��C����
=0.025��C����
D��Ͷ�ϱ�Ϊ2ʱ��Q��δ�ﵽƽ��״̬��P��Ϊƽ��״̬��Q����Ҫ�ﵽƽ��״̬����Ҫ��Ӧ������У���ʱ�淴Ӧ����С��P��ƽ��״̬�µ��淴Ӧ���ʣ���Q��v��(CH4)С��P���v��(CH4)��D��ȷ��
�ʺ���ѡ����C��

 �߽�������ϵ�д�
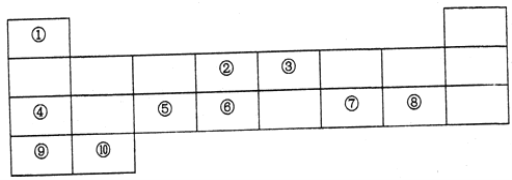
�߽�������ϵ�д�����Ŀ������п���㷺Ӧ����ҽҩ�����ũҵ��������ҵ��������п����Ҫ�ɷ�ΪZnO������ZnSiO3��FeCO3��CuO�ȣ�����ZnSO47H2O��һ��������ͼ��

��1���������IJ�����____________��
��2������������ϡ����������ʱ���費��ͨ�����ˮ������Ŀ����______________��
��3���������У���pHԼΪ5.1����Һ�м��������أ�����Fe(OH)3��MnO(OH)2���ֳ������÷�Ӧ�����ӷ���ʽΪ____________________________________________��
��4���������У�����п�۵�������______________��
��5����֪����п���ܽ�����¶�֮��Ĺ�ϵ���±���
�¶�/�� | 0 | 20 | 40 | 60 | 80 | 100 |
�ܽ��/g | 41.8 | 54.1 | 70.4 | 74.8 | 67.2 | 60.5 |
������п��Һ�л������п�����ʵ�����Ϊ________________����ȴ�ᾧ�����ˡ���ɲ������ڼ�ѹ���������½��У�ԭ����_________________________________��
��6��ȡ28.70 g ZnSO47H2O��������ͬ�¶ȣ�ʣ�����������仯��ͼ��ʾ���������ݣ�680��ʱ���ù���Ļ�ѧʽΪ______��

a��ZnO b��Zn3O(SO4)2 c��ZnSO4 d��ZnSO4H2O
����Ŀ����2L�����ܱ������г���A(g)��B(g)��������ӦA(g)+B(g) ![]() 2C(g)+D(s)������ʵ���������±���
2C(g)+D(s)������ʵ���������±���
ʵ���� | �¶�/�� | ��ʼʱ���ʵ���/mol | ƽ��ʱ���ʵ���/mol | |
n(A) | n(B) | n(C) | ||
�� | 600 | 0.30 | 0.20 | 0.30 |
�� | 700 | 0.20 | 0.30 | 0.24 |
�� | 800 | 0.10 | 0.10 | a |
����˵������ȷ����
A. ʵ����У���5minʱ���n(B)=0.050mol����0��5minʱ����ƽ����Ӧ����v(A)=0.015mol/(L��min)
B. ʵ����дﵽƽ�������ѹǿ��A��ת���ʲ��䣬ƽ�ⳣ������
C. 700��ʱ�÷�Ӧ��ƽ�ⳣ��K=4.0
D. ʵ����У��ﵽƽ��ʱ��a>0.10