题目内容
8.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )| A. | 1molSiO2含有2NA个Si-O键 | |
| B. | 1molNa2O2固体中含离子总数为3NA. | |
| C. | 标准状况下,22.4 L SO3所含分子数为NA. | |
| D. | 1L0.5mol/L的MgCl2溶液中,含有Mg2+个数为0.5NA. |
分析 A、依据二氧化硅结构分析判断;
B、过氧化钠中阴离子为过氧根离子,1mol过氧化钠中含有2mol钠离子、1mol过氧根离子,总共含有3mol离子;
C、标准状况下,22.4 L SO3为固态;
D、根据氢氧化镁为弱碱,Mg2+要发生水解;
解答 解:A、1molSiO2晶体内含有4NA个Si-O键,故A错误;
B、过氧化钠中阴离子为过氧根离子,1mol过氧化钠中含有2mol钠离子、1mol过氧根离子,总共含有3mol离子,含阴、阳离子的总数为3NA,故B正确;
C、标准状况下,22.4 L SO3为固态,故C错误;
D、因为氢氧化镁为弱碱,Mg2+要发生水解,所以1L0.5mol/L的MgCl2溶液中,含有Mg2+个数小于0.5NA,故D错误;
故选:B.
点评 本题考查了阿伏伽德罗常的应用,主要考查二氧化硅的结构,过氧化钠的电离,题目难度中等,注意明确标况下气体摩尔体积的使用条件,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系.

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目
18.下列关于碳氢化合物的叙述正确的是( )
| A. | 碳氢化合物的通式为CnH2n+2 | |
| B. | 烷烃中都有碳碳单键 | |
| C. | 烷烃分子中的碳原子只能在一条链上,不能出现支链 | |
| D. | 烷烃分子中可能出现n个甲基(n=1,2,3…) |
19.下列叙述正确的是( )
| A. | 直径介于1nm~100nm之间的微粒称为胶体 | |
| B. | 电泳现象可证明胶体属于电解质溶液 | |
| C. | 胶体粒子很小,可以透过半透膜 | |
| D. | 利用丁达尔效应可以区别溶液与胶体 |
16.Mg-AgCl电池是一种用海水激活的一次电池,在军事上用作电动鱼雷的电源.电池的总反应可表示为:Mg+2AgCl═MgCl2+2Ag.下列关于该电池说法错误的是( )
| A. | 该电池工作时,正极反应为:2AgCl+2e-═2Cl-+2Ag | |
| B. | 镁电极作该电池负极,负极反应为:Mg-2e-═Mg2+ | |
| C. | 当有24g Mg被氧化时,有108 g AgCl被还原 | |
| D. | 装备该电池的鱼雷在水中行进时,海水作为电解质溶液 |
3.化学与人体健康、环境、生产、生活密切相关,下列说法不正确的是( )
| A. | 高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路” | |
| B. | 用K2FeO4代替Cl2处理饮用水,既有杀菌消毒作用,也可以起净水作用 | |
| C. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| D. | 我国居民普遍存在缺铁性贫血,可在酱油中添加亚铁盐予以改善并同时补充服用维生素C |
13.下列反应的化学方程式错误的是( )
| A. | 苯与液溴制溴苯的反应: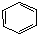 +Br2$\stackrel{FeBr_{3}}{→}$ +Br2$\stackrel{FeBr_{3}}{→}$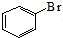 +HBr +HBr | |
| B. | 乙酸与乙醇的酯化反应:CH3COOH+CH3CH2${\;}_{\;}^{18}$OH$→_{△}^{浓H_{2}SO_{4}}$CH3CO${\;}_{\;}^{18}$OCH2CH3+H2O | |
| C. | 溴乙烷与NaOH水溶液混和共热 CH3CH2Br+NaOH$→_{△}^{水}$CH2=CH2+H2O+NaBr | |
| D. | 乙醇的消去反应 CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O |
20.把500mL含有BaCl2和KCl的混合溶液分成5等份,取一份加入含a mol 硫酸钠的溶液恰好使钡离子完全沉淀;另取一份加入含b mol 硝酸银的溶液,恰好使氯离子完全沉淀.则该混合溶液中钾离子浓度为( )
| A. | 0.1 ( b-2a ) mol/L | B. | 10 ( 2a-b ) mol/L | ||
| C. | 10 ( b-a ) mol/L | D. | 10 ( b-2a ) mol/L |
17.有4个系列同族元素的物质,101.3kPa时测定它们的沸点(℃)如下表所示:
对应表中内容,下列叙述中正确的是( )
| ① | He-268.8 | (a)-249.5 | Ar-185.8 | Kr-151.7 |
| ② | F2-187.0 | Cl2-33.6 | (b) 58.7 | I2 184.0 |
| ③ | (c) 19.4 | HCl-84.0 | HBr-67.0 | HI-35.3 |
| ④ | H2O 100.0 | H2S-60.0 | (d)-42.0 | H2Te-1.8 |
| A. | 系列①的(a)物质中没有离子键,应有共价键和分子间作用力 | |
| B. | 系列③中(c)物质的沸点比HCl高是因为(c)中的共价键更牢固 | |
| C. | 系列②中(b)物质的元素的原子序数应为35,且该物质常温下为液态 | |
| D. | 系列④中H2O沸点变化出现反常,是因为分子内有氢键的影响 |
18.下列装置或操作能达到实验目的是( )
| A. | 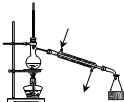 用于蒸馏石油 | B. | 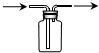 用于收集NO | ||
| C. |  用于分离乙酸和乙酸乙酯混合物 | D. | 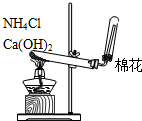 用于实验室制取NH3 |