题目内容
16.Mg-AgCl电池是一种用海水激活的一次电池,在军事上用作电动鱼雷的电源.电池的总反应可表示为:Mg+2AgCl═MgCl2+2Ag.下列关于该电池说法错误的是( )| A. | 该电池工作时,正极反应为:2AgCl+2e-═2Cl-+2Ag | |
| B. | 镁电极作该电池负极,负极反应为:Mg-2e-═Mg2+ | |
| C. | 当有24g Mg被氧化时,有108 g AgCl被还原 | |
| D. | 装备该电池的鱼雷在水中行进时,海水作为电解质溶液 |
分析 该原电池中,Mg失电子发生氧化反应而作负极,AgCl是正极,负极反应式为Mg-2e-═Mg2+,正极反应式为2AgCl+2e-═2Cl-+2Ag,根据转移电子守恒进行有关计算.
解答 解:该原电池中,Mg失电子发生氧化反应而作负极,AgCl是正极,负极反应式为Mg-2e-═Mg2+,正极反应式为2AgCl+2e-═2Cl-+2Ag,
A.正极上AgCl得电子发生还原反应,电极反应式为2AgCl+2e-═2Cl-+2Ag,故A正确;
B.该反应中Mg失电子发生氧化反应作负极,负极反应式为Mg-2e-═Mg2+,故B正确;
C.根据方程式知,如果有24gMg被氧化,则有216gAgCl被还原,故C错误;
D.Mg-AgCl电池是一种用海水激活的一次电池,所以装备该电池的鱼雷在水中行进时,海水作为电解质溶液,故D正确;
故选C.
点评 本题考查化学电源新型电池,为高频考点,会根据元素化合价变化确定正负极及正负极上发生的反应,难点是电极反应式的书写,题目难度不大.

练习册系列答案
 导学全程练创优训练系列答案
导学全程练创优训练系列答案
相关题目
4.乳酸的结构简式是CH3-CH(OH)-COOH,下列有关乳酸的说法中正确的是( )
| A. | 乳酸中不含羟基 | |
| B. | 乳酸不能发生消去反应 | |
| C. | 乳酸与足量钠反应时物质的量之比为1:1 | |
| D. | 乳酸与足量NaOH溶液反应时物质的量之比为1:1 |
8.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 1molSiO2含有2NA个Si-O键 | |
| B. | 1molNa2O2固体中含离子总数为3NA. | |
| C. | 标准状况下,22.4 L SO3所含分子数为NA. | |
| D. | 1L0.5mol/L的MgCl2溶液中,含有Mg2+个数为0.5NA. |
5.现有A、B、C、D、E五种可溶强电解质,它们在水中可电离产生下列离子(各种离子不重复).
已知:①A、B两溶液呈碱性;C、D、E溶液呈酸性.
②向E溶液中逐滴滴加B溶液至过量,沉淀量先增加后减少但不消失.
③D溶液与另外四种溶液反应都能产生沉淀.
试回答下列问题:
(1)A溶液呈碱性的原因是CO32-+H2O?HCO3-+OH-.(写出有关离子方程式)
(2)若25℃时C、E溶液pH=4,则E溶液中水电离出的氢离子浓度是C溶液中水电离出的氢离子浓度106倍.
(3)将0.1mol•L-1的C溶液逐滴加入等体积、0.2mol•L-1的A溶液中,反应后溶液中离子浓度由大到小的顺序为:c(Na+)>c(HCO3-)>c(Cl-)>c(CO32-)>c(OH-)>c(H+).
| 阳离子 | H+、Na+、A13+、Ag+、Ba2+ |
| 阴离子 | OH-、C1-、CO32-、NO3-、SO42- |
②向E溶液中逐滴滴加B溶液至过量,沉淀量先增加后减少但不消失.
③D溶液与另外四种溶液反应都能产生沉淀.
试回答下列问题:
(1)A溶液呈碱性的原因是CO32-+H2O?HCO3-+OH-.(写出有关离子方程式)
(2)若25℃时C、E溶液pH=4,则E溶液中水电离出的氢离子浓度是C溶液中水电离出的氢离子浓度106倍.
(3)将0.1mol•L-1的C溶液逐滴加入等体积、0.2mol•L-1的A溶液中,反应后溶液中离子浓度由大到小的顺序为:c(Na+)>c(HCO3-)>c(Cl-)>c(CO32-)>c(OH-)>c(H+).
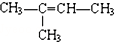
 .
.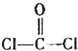 的空间结构为平面三角形.
的空间结构为平面三角形.