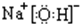题目内容
13.下列反应的化学方程式错误的是( )| A. | 苯与液溴制溴苯的反应: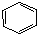 +Br2$\stackrel{FeBr_{3}}{→}$ +Br2$\stackrel{FeBr_{3}}{→}$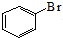 +HBr +HBr | |
| B. | 乙酸与乙醇的酯化反应:CH3COOH+CH3CH2${\;}_{\;}^{18}$OH$→_{△}^{浓H_{2}SO_{4}}$CH3CO${\;}_{\;}^{18}$OCH2CH3+H2O | |
| C. | 溴乙烷与NaOH水溶液混和共热 CH3CH2Br+NaOH$→_{△}^{水}$CH2=CH2+H2O+NaBr | |
| D. | 乙醇的消去反应 CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O |
分析 A.苯和液溴在溴化铁作催化剂条件下发生取代反应生成溴苯;
B.乙酸和乙醇发生酯化反应生成乙酸乙酯,乙酸中羧基上-OH断裂、乙醇中醇羟基上O-H断裂;
C.溴乙烷和氢氧化钠的水溶液加热发生取代反应,和氢氧化钠的醇溶液加热发生消去反应;
D.乙醇在170℃、浓硫酸作催化剂条件下发生消去反应.
解答 解:A.苯和液溴在溴化铁作催化剂条件下发生取代反应生成溴苯,反应方程式为 +Br2$\stackrel{FeBr_{3}}{→}$
+Br2$\stackrel{FeBr_{3}}{→}$ +HBr,故A正确;
+HBr,故A正确;
B.乙酸和乙醇发生酯化反应生成乙酸乙酯,乙酸中羧基上-OH断裂、乙醇中醇羟基上O-H断裂,反应方程式为CH3COOH+CH3CH2${\;}_{\;}^{18}$OH$→_{△}^{浓H_{2}SO_{4}}$CH3CO${\;}_{\;}^{18}$OCH2CH3+H2O,故B正确;
C.溴乙烷和氢氧化钠的水溶液加热发生取代反应,和氢氧化钠的醇溶液加热发生消去反应,取代反应方程式为CH3CH2Br+NaOH$→_{△}^{水}$CH3CH2OH+NaBr,故C错误;
D.乙醇在170℃、浓硫酸作催化剂条件下发生消去反应,反应方程式为CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O,故D正确;
故选C.
点评 本题考查化学反应方程式正误判断,明确反应条件及产物是解本题关键,有些化学反应产物受反应条件、反应物浓度、反应物的量影响,注意B中断键和成键方式,为易错点.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案
相关题目
3.金属元素广泛存在与各种矿石和海水中,不同金属的冶炼方法各不相同.下列关于金属冶炼说法正确的是( )
| A. | 不同金属的冶炼方法选择的原则主要是依据金属离子得电子的能力 | |
| B. | 金属的冶炼都是置换反应 | |
| C. | 应该大力开发金属矿物资源以满足人类生产生活的需要 | |
| D. | 工业上从海水中提取镁:海水$\stackrel{石灰乳}{→}$Mg(OH)2$\stackrel{灼烧}{→}$MgO$\stackrel{电解}{→}$Mg |
4.乳酸的结构简式是CH3-CH(OH)-COOH,下列有关乳酸的说法中正确的是( )
| A. | 乳酸中不含羟基 | |
| B. | 乳酸不能发生消去反应 | |
| C. | 乳酸与足量钠反应时物质的量之比为1:1 | |
| D. | 乳酸与足量NaOH溶液反应时物质的量之比为1:1 |
8.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 1molSiO2含有2NA个Si-O键 | |
| B. | 1molNa2O2固体中含离子总数为3NA. | |
| C. | 标准状况下,22.4 L SO3所含分子数为NA. | |
| D. | 1L0.5mol/L的MgCl2溶液中,含有Mg2+个数为0.5NA. |
18.在下列反应中,化学式下面画有短线的物质只作氧化剂的是( )
| A. | 2NH3+3Cl2═N2+6HCl | B. | 2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$ N2+3Cu+3H2O | ||
| C. | Cl2+2NaOH═NaCl+NaClO+H2O | D. | KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O |
5.现有A、B、C、D、E五种可溶强电解质,它们在水中可电离产生下列离子(各种离子不重复).
已知:①A、B两溶液呈碱性;C、D、E溶液呈酸性.
②向E溶液中逐滴滴加B溶液至过量,沉淀量先增加后减少但不消失.
③D溶液与另外四种溶液反应都能产生沉淀.
试回答下列问题:
(1)A溶液呈碱性的原因是CO32-+H2O?HCO3-+OH-.(写出有关离子方程式)
(2)若25℃时C、E溶液pH=4,则E溶液中水电离出的氢离子浓度是C溶液中水电离出的氢离子浓度106倍.
(3)将0.1mol•L-1的C溶液逐滴加入等体积、0.2mol•L-1的A溶液中,反应后溶液中离子浓度由大到小的顺序为:c(Na+)>c(HCO3-)>c(Cl-)>c(CO32-)>c(OH-)>c(H+).
| 阳离子 | H+、Na+、A13+、Ag+、Ba2+ |
| 阴离子 | OH-、C1-、CO32-、NO3-、SO42- |
②向E溶液中逐滴滴加B溶液至过量,沉淀量先增加后减少但不消失.
③D溶液与另外四种溶液反应都能产生沉淀.
试回答下列问题:
(1)A溶液呈碱性的原因是CO32-+H2O?HCO3-+OH-.(写出有关离子方程式)
(2)若25℃时C、E溶液pH=4,则E溶液中水电离出的氢离子浓度是C溶液中水电离出的氢离子浓度106倍.
(3)将0.1mol•L-1的C溶液逐滴加入等体积、0.2mol•L-1的A溶液中,反应后溶液中离子浓度由大到小的顺序为:c(Na+)>c(HCO3-)>c(Cl-)>c(CO32-)>c(OH-)>c(H+).
3.将a g铜镁铝铁合金溶解在一定量的浓硝酸中,当合金完全溶解时,收集到NO,NO2,N2O4,N2O混合气体.该混合气体与标准状况下V L O2充分混合通入水中恰好完全被水吸收.再向反应后的溶液中加入过量的氨水,得到沉淀.若用守恒法求沉淀的质量,用到的守恒关系依次是( )
| A. | 质量守恒、电子守恒、电荷守恒 | B. | 电子守恒、质量守恒、电荷守恒 | ||
| C. | 电子守恒、电荷守恒、质量守恒 | D. | 电荷守恒、质量守恒、电子守恒 |