题目内容
【题目】某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。已知:p(Ba2+)=-lgc(Ba2+),p(SO42-)=-lg c(SO42-)。下列说法正确的是( )
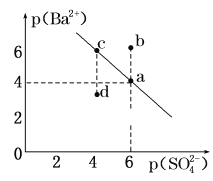
A.加入BaCl2可以使溶液由c点变到a点
B.a点的Ksp(BaSO4)小于b点的Ksp(BaSO4)
C.d点表示的是该温度下BaSO4的不饱和溶液
D.该温度下,Ksp(BaSO4)=1.0×10-24
【答案】A
【解析】
A、在BaSO4的溶液中,存在平衡:BaSO4(s)![]() Ba2+(aq)+SO42-(aq),加入BaCl2,使得c(Ba2+)增大,平衡逆向移动,导致c(SO42)减小,即p(Ba2+)减小,p(SO42-)增大,由于溶液中该平衡始终存在,故可以使溶液由c点变到a点,A正确;
Ba2+(aq)+SO42-(aq),加入BaCl2,使得c(Ba2+)增大,平衡逆向移动,导致c(SO42)减小,即p(Ba2+)减小,p(SO42-)增大,由于溶液中该平衡始终存在,故可以使溶液由c点变到a点,A正确;
B、Ksp只和温度有关,温度不变,Ksp不变,所以a、b两点Ksp(BaSO4)相同,B错误;
C、d点和c点相比,p(Ba2+)d< p(Ba2+)c,则c(Ba2+)d>c(Ba2+)c,则d点表示的是BaSO4的饱和溶液,C错误;
D、该温度下,a点,p(Ba2+)=4,p(SO42-)=6,则c(Ba2+)=10-4mol/L,c(SO42)=10-6mol/L,则Ksp(BaSO4)= c(Ba2+)·c(SO42)=10-10,D错误;
故选A。

 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案【题目】W、X、Y、Z是短周期元素,其部分性质如下表:
W | 单质是淡黄色固体 |
X | 在地壳中的含量居第二位 |
Y | 原子最外层电子数是电子总数的 |
Z | 第三周期原子半径最小的金属元素 |
下列说法正确的是
A. 气态氢化物的热稳定性:X>W B. Z的氧化物中含有非极性共价键
C. 离子半径:Z>W D. 最高价氧化物对应水化物的酸性:Y>X
【题目】某温度下,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表,下列说法错误的是
物质 | X Y Z |
初始浓度/mol·L-1 | 0.1 0.2 0 |
平衡浓度/mol·L-1 | 0.05 0.05 0.1 |
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y![]() 2Z
2Z
C.平衡常数 K = 1600 mol-2·L2
D.增大压强和升高温度,平衡正方向移动