题目内容
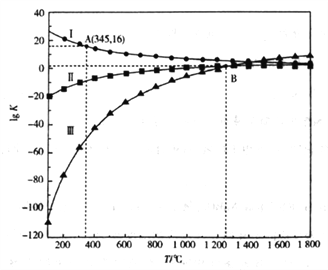
【题目】常温下,Ksp(CaSO4)= 9×10-4,常温下CaSO4在水中的沉淀溶解平衡曲线如图所示。下列判断中正确的是

A. a点对应的溶液中c(H+)·c(OH-) 的数值为1×10-14
B. a 点对应的Ksp不等于c点对应的Ksp
C. b 点将有沉淀生成,平衡后溶液中c(SO42-)= 3×10-3mol/L,而向d 点溶液中加入适量的CaSO4固体可以变到c 点
D. CaSO4的饱和溶液中c(SO42-) > c(Ca2+) >c(H+) >c(OH-)
【答案】A
【解析】A、常温下,水的离子积常数为1×10-14,故a点对应的溶液中c(H+)·c(OH-) =Kw=1×10-14,选项A正确;B、Ksp是一常数,温度不变Ksp不变,在曲线上的任意一点Ksp都相等,选项B错误;C、d根据图示数据,可以看出b点Qc=2×l0-5>Ksp,所以会生成沉淀,平衡向生成沉淀的方向进行,此时溶液中c(SO42-)会小于4×l0-3mol/L,由于c(Ca2+)>c(SO42-),则c(SO42-)小于3×l0-3mol/L;升高温度,有利于溶解平衡正向移动,所以硫酸根的浓度会增大,向d 点溶液中加入适量的CaSO4固体不能变到c 点,选项C错误;D、CaSO4是强酸强碱盐,不水解,溶液呈中性,故CaSO4的饱和溶液中c(SO42-) = c(Ca2+) >c(H+) =c(OH-),选项D错误。答案选A。

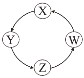
【题目】下列各组物质中,满足表中图示物质在一定条件下一步转化关系的组合有
序号 | X | Y | Z | W |
|
① | Si | Na2SiO3 | H2SiO3 | SiO2 | |
② | Na | NaOH | Na2CO3 | NaCl | |
③ | Cl2 | Ca(ClO)2 | HClO | HCl | |
④ | Fe | FeCl3 | FeCl2 | Fe(OH)2 |
A. ①②③ B. ①③④ C. ②③ D. ①④