题目内容
【题目】氯气与碱溶液反应,在低温、稀碱溶液中主要产物是 ClO3-和 Cl-,在 75℃以上、浓碱溶液中主要产物是ClO-和 Cl-。研究小组用如下实验装置制取氯酸钾(KClO3),并测定其纯度。(夹持装置已省略)
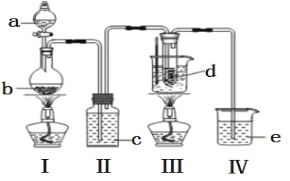
a 为浓盐酸,b 为MnO2,c 为饱和食盐水, d 为 30%KOH 溶液,e 为 NaOH 溶液
回答下列问题:
(1)检查装置气密性后,添加药品,待装置 III 水温升至 75℃开始反应。
①装置 II 的作用为_____________________________________。
②若取消装置 II,对本实验的影响是___________________。
③从装置 III 的试管中分离得到 KClO3 粗产品,其中混有的杂质是 KClO 和_____________(填化学式)。
(2)为测定产品 KClO3 的纯度,进行如下实验:
步骤 1:取 3.00g 样品溶于水配成 250mL 溶液。
步骤 2:取 25.00mL 溶液于锥形瓶中,滴加足量H2O2 溶液充分振荡以除尽ClO-。然后煮沸溶液 1~2 分钟,冷却。
步骤 3:加入过量KI溶液,再逐滴加入足量稀硫酸。(ClO3- +6I- +6H+= Cl-+3I2+3H2O)
步骤 4:加入指示剂,用 0.600mol/LNa2S2O3 标准溶液滴定至终点,消耗标准溶液 20.00mL。(2S2O32-+I2=S4O62-+2I-)
步骤 2 中除去 ClO-的离子方程式是_________________。
②样品中 KClO3 的貭量分数为_____。(保留三位有效数字,KClO3 式量:122.5)
【答案】除去氯气中混有的氯化氢气体,避免影响产率 氯化氢气体进入装置Ⅲ消耗KOH,使KClO3产量降低 KCl ClO-+ H2O2![]() Cl-+O2↑+H2O 81.7%
Cl-+O2↑+H2O 81.7%
【解析】
氯气与碱溶液反应,在低温、稀碱溶液中主要产物是 ClO3-和 Cl-,在 75℃以上、浓碱溶液中主要产物是ClO-和 Cl-。装置Ⅰ制备氯气,装置Ⅱ使用饱和食盐水除去氯化氢气体,氯气通入装置Ⅲ进行反应,装置Ⅳ用于尾气处理。
(1)①根据分析,装置Ⅱ的作用是除去氯气中混有的氯化氢气体,避免影响产率;②若取消装置 II,氯化氢气体进入装置Ⅲ消耗KOH,使KClO3产量降低;③在 75℃以上、浓碱溶液中主要产物是ClO-和 Cl-,故从装置 III 的试管中分离得到 KClO3 粗产品,其中混有的杂质是KClO和KCl;
(2) ①碱性条件,ClO-有强氧化性,ClO3-氧化性较弱, H2O2溶液可以氧化ClO-而不能氧化ClO3-,从而可以进行实验测定含量。滴加足量H2O2溶液充分振荡以除尽ClO-,该过程中ClO-被还原为Cl-,H2O2溶液被氧化为O2,故发生的离子反应式为ClO-+ H2O2![]() Cl-+O2↑+H2O;②根据离子反应式定量关系式ClO3-~3I2 ~6S2O32-,故消耗20.00mL 0.600mol/L Na2S2O3物质的量为0.012mol,则25.00mL样品溶液KClO3物质的量为0.002mol,则250mL溶液KClO3物质的量为0.02mol,所含质量2.45g,质量分数为81.7%。
Cl-+O2↑+H2O;②根据离子反应式定量关系式ClO3-~3I2 ~6S2O32-,故消耗20.00mL 0.600mol/L Na2S2O3物质的量为0.012mol,则25.00mL样品溶液KClO3物质的量为0.002mol,则250mL溶液KClO3物质的量为0.02mol,所含质量2.45g,质量分数为81.7%。

【题目】某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示:

(1)由图中所给数据进行分析,该反应的化学方程式为__________。
(2)若上述反应中X、Y、Z分别为H2、N2、NH3,某温度下,在容积恒定为2.0L的密闭容器中充入2.0mol N2和2.0mol H2,一段时间后反应达平衡状态,实验数据如表所示:
t/s | 0 | 50 | 150 | 250 | 350 |
n(NH3) | 0 | 0.36 | 0.48 | 0.50 | 0.50 |
0~50s内的平均反应速率v(N2)=__________。
(3)已知:键能指在标准状况下,将1mol气态分子AB(g)解离为气态原子A(g)、B(g)所需的能量,用符号E表示,单位为kJ/mol。H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,生成1mol NH3过程中放出46kJ的热量。则N≡N的键能为_________kJ/mol。