题目内容
【题目】“封管实验”具有简易、方便、节约、绿色等优点,下列关于四个“封管实验”![]() 夹持装置未画出、
夹持装置未画出、![]() 固体易升华
固体易升华![]() 的说法正确的是
的说法正确的是
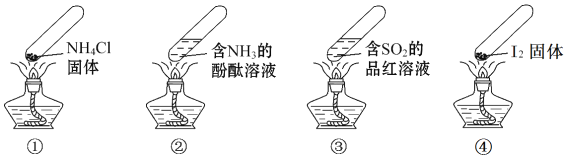
A. 加热时,![]() 中封管内固体消失
中封管内固体消失
B. 加热时,![]() 中溶液变红,冷却后又变为无色
中溶液变红,冷却后又变为无色
C. 加热时,![]() 中溶液变红,冷却后红色褪去,体现
中溶液变红,冷却后红色褪去,体现![]() 的漂白性
的漂白性
D. 加热又冷却的过程中,![]() 属于物理变化,
属于物理变化,![]() 属于化学变化
属于化学变化
【答案】C
【解析】
A.氯化铵不稳定,加热分解生成氨气和氯化氢,温度稍低时又生成氯化铵;B.含有氨气的酚酞溶液为红色,加热后氨气逸出,溶液变为无色,冷却后溶液又会变红色;C.二氧化硫具有漂白性,加热后溶液变红,冷却后溶液褪色;D.氯化铵的分解为化学变化。
A.氯化铵不稳定,加热分解生成氨气和氯化氢,温度稍低时又生成氯化铵,则封管内固体不消失,故A错误;B.加热时氨气逸出,溶液的颜色为无色,冷却后氨气溶解溶液变为红色,故B错误;C.加热后二氧化硫逸出,溶液呈红色,冷却后二氧化硫又将品红溶液漂白,故C正确;D.氯化铵的分解生成氨气和氯化氢,有新物质生成,为化学变化,故D错误。故答案C。

【题目】已知:H2(g)+I2(g)![]() 2HI(g)△H=-14.9kJ·mol-1。某温度下,在体积均为2.0L的甲、乙两个恒容密闭容器中充入反应物,其起始物质的量如下表所示。甲中反应达到平衡时,测得c(H2)=0.008mol·L-1。下列判断正确的是( )
2HI(g)△H=-14.9kJ·mol-1。某温度下,在体积均为2.0L的甲、乙两个恒容密闭容器中充入反应物,其起始物质的量如下表所示。甲中反应达到平衡时,测得c(H2)=0.008mol·L-1。下列判断正确的是( )
起始物质的量 | n(H2)/mol | n(I2)/mol | n(HI)/mol |
甲 | 0.02 | 0.02 | 0 |
乙 | 0.04 | 0.04 | 0 |
A. 平衡时,乙中H2的转化率是甲中的2倍
B. 平衡时,甲中混合物的颜色比乙中深
C. 平衡时,甲、乙中热量的变化值相等
D. 该温度下,反应的平衡常数K=0.25
【题目】某课外学习小组在学习了![]() 与
与![]() 的反应后,认为
的反应后,认为![]() 与
与![]() 应该也可以反应。他们设计了如图装置
应该也可以反应。他们设计了如图装置![]() 夹持装置已略去,装置的气密性良好
夹持装置已略去,装置的气密性良好![]() 进行实验,探究
进行实验,探究![]() 与
与![]() 反应的产物,请按要求回答下列问题。
反应的产物,请按要求回答下列问题。
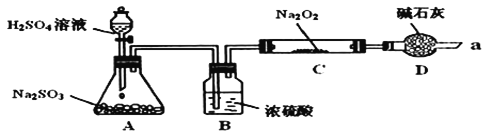
Ⅰ![]() 写出装置A中发生反应的化学方程式:______。
写出装置A中发生反应的化学方程式:______。
Ⅱ![]() 装置D的作用:除了可以防止空气中的
装置D的作用:除了可以防止空气中的![]() 、水蒸气等进入C中与
、水蒸气等进入C中与![]() 反应,还可以______________________________________________________。
反应,还可以______________________________________________________。
Ⅲ![]() 在通入足量的
在通入足量的![]() 与
与![]() 充分反应后,他们对C中固体产物提出如下假设:
充分反应后,他们对C中固体产物提出如下假设:
假设1:只有![]() ;
;
假设2:___________;
假设3:既有![]() ,又有
,又有![]() 。
。
(1)若假设2成立,写出![]() 与
与![]() 反应的化学方程式:_________________。
反应的化学方程式:_________________。
(2)某同学设计了如下实验进一步确认产物的成分。
实验步骤 | 现象 |
| 固体全部溶解 |
| 酸性 |
| 产生白色沉淀 |
步骤![]() 中将产生的气体通入少量酸性
中将产生的气体通入少量酸性![]() 溶液中,发生反应的离子方程式为:______。通过上述实验现象确定假设______成立。
溶液中,发生反应的离子方程式为:______。通过上述实验现象确定假设______成立。![]() 选填1、2或
选填1、2或![]()