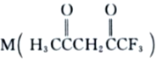题目内容
【题目】已知:H2O(g)=H2O(l) ΔH=Q1 kJ·mol-1
C2H5OH(g)=C2H5OH(l)ΔH=Q2 kJ·mol-1
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g)ΔH=Q3 kJ·mol-1
若使46 g液体酒精完全燃烧,最后恢复到室温,则放出的热量为
A. -(3Q1-Q2+Q3) kJB. -0.5(Q1+Q2+Q3) kJ
C. -(0.5Q1-1.5Q2+0.5Q3) kJD. -(Q1+Q2+Q3) kJ
【答案】A
【解析】
根据盖斯定律,利用已知的反应计算出C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)的反应热△H,利用乙醇的物质的量与反应放出的热量成正比来解答。
①H2O(g)═H2O(l)△H1=Q1kJmol-1,②C2H5OH(g)═C2H5OH(l)△H2=Q2kJmol-1,③C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g)△H3=Q3kJmol-1,根据盖斯定律,①×3+③-②得C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l),故△H=(3Q1+Q3-Q2)kJ/mol,该反应为放热反应,△H=(3Q1+Q3-Q2)kJ/mol<0;46g液体酒精的物质的量为![]() =1mol,故1mol液态乙醇完全燃烧并恢复至室温,则放出的热量为-(3Q1 +Q3-Q2) kJ,故选A。
=1mol,故1mol液态乙醇完全燃烧并恢复至室温,则放出的热量为-(3Q1 +Q3-Q2) kJ,故选A。

 阅读快车系列答案
阅读快车系列答案【题目】Ⅰ.利用测压法在刚性反应器中研究 T℃ 时:
3NO2(g)![]() 3NO(g)+O3(g) ΔH=+317.3kJ·mol-1的分解反应,体系的总压强 p随时间 t 的变化如下表所示:
3NO(g)+O3(g) ΔH=+317.3kJ·mol-1的分解反应,体系的总压强 p随时间 t 的变化如下表所示:
反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
压强/MPa | 20.00 | 21.38 | 22.30 | 23.00 | 23.58 | 24.00 | 24.00 |
(1)该反应达到平衡后的熵值较平衡前______________(填“增大”“减小”“不变”)。
(2)若降低反应温度,则平衡后体系压强 p____24.00 MPa(填“大于”“等于”“小于”),原因是_____________________________________________________________________。15min 时,反应物的转化率 α=__________%
Ⅱ.一定条件下,在体积为 2 L 的密闭容器中发生反应:2NO2(g)![]() 2NO(g)+O2(g) ΔH>0。投入 2 mol NO2发生反应。实验测得:v正=k正c2(NO2),v逆=k逆c2(NO)·c(O2),k正、k逆为速率常数,受温度影响。在温度为 T℃ 时 NO2 的转化率随时间变化的结果如图所示。
2NO(g)+O2(g) ΔH>0。投入 2 mol NO2发生反应。实验测得:v正=k正c2(NO2),v逆=k逆c2(NO)·c(O2),k正、k逆为速率常数,受温度影响。在温度为 T℃ 时 NO2 的转化率随时间变化的结果如图所示。
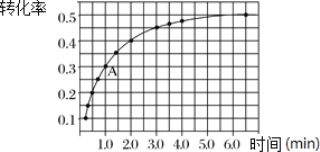
(1)要提高 NO2转化率,可采取的措施是________________ 、__________________。
(2)前2min内,以NO2表示该反应的化学反应速率为___________________。
(3)计算 A 点处v正/ v逆=_________________(保留一位小数)。