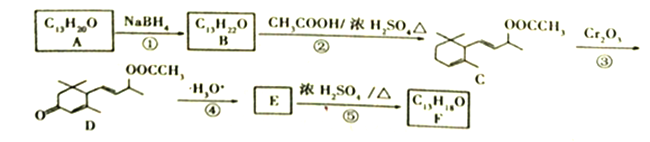
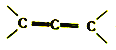
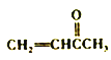��Ŀ����
����Ŀ��X��Y��Z��RΪǰ������ԭ���������������Ԫ�ء�Xԭ����3���ܼ�����ÿ���ܼ��ϵĵ�������ȣ�Zԭ�ӵIJ��ɶԵ�������ͬ��������࣬��Z����̬�⻯����ͬ����Ԫ�ص��⻯���зе���ͣ�X��Y��R��Ԫ�������ڱ���ͬ�塣
��1��RԪ�������ڱ��е�λ����_____________�����̬ԭ�ӵĵ����Ų�ʽΪ[Ar]_______��
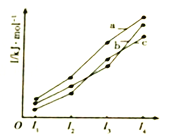
��2����ͼ��ʾX��Y��Z���ļ������ܱ仯���ƣ����б�ʾZ��������_______(����)��
��3��������(XH2=X=O)������Xԭ���ӻ����������____________��1mol(X2H5O)3Z=O�����к��е���������������Ŀ��Ϊ__________________��
��4��Z��������Ӧ������һ�ָ�ԭ�Ӿ�����8�����ȶ��ṹ�Ļ��������ӵĿռ乹��Ϊ_____��
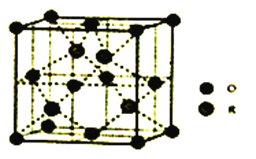
��5��ijR�������ᄃ���ṹ��ͼ��ʾ�������ʵĻ�ѧʽΪ_______________����֪�þ����ܶ�Ϊpg��cm-3���������������ԭ�ӵľ���Ϊdpm����R�����ԭ�������������ʽΪ___________________________(��֪lpm=10-12m�������ӵ�����ΪNA)��
��6��X�γɵ�һ�ֳ������ʣ�����Ӳ���࣬ԭ����_______________________��
���𰸡� ����������A�� 3d104s24p2 b sp��sp2 25:1 �����λ������� GeO��Ge4O4 ![]() ̼̼�����ܴ����ۼ��з����ԣ�����������ԭ�ӽṹ��λ�����ѣ���Ӳ���ࡣ
̼̼�����ܴ����ۼ��з����ԣ�����������ԭ�ӽṹ��λ�����ѣ���Ӳ���ࡣ
�����������������Xԭ����3���ܼ�����ÿ���ܼ��ϵĵ�������ȣ�X��CԪ�أ�Zԭ�ӵIJ��ɶԵ�������ͬ��������࣬��Z����̬�⻯����ͬ����Ԫ�ص��⻯���зе���ͣ�Z��PԪ�أ�X��Y��R��Ԫ�������ڱ���ͬ�壬 Y��R�ֱ���Si��Ge��
��������1��R��GeԪ�أ������ڱ��е�λ���ǵ���������A�壬Ge������32�����������̬ԭ�ӵĵ����Ų�ʽΪ[Ar] 3d104s24p2����2��Pԭ�Ӽ۵����Ų���3s23p3���ĵ����ܱȵ�������������������������ʾP��������b����3�������� �����Тٺ�Cԭ����3��
�����Тٺ�Cԭ����3��![]() �� ���¶Ե��ӣ������ӻ����������sp2���ں�Cԭ����2��
�� ���¶Ե��ӣ������ӻ����������sp2���ں�Cԭ����2��![]() ���¶Ե��ӣ������ӻ����������sp��������
���¶Ե��ӣ������ӻ����������sp��������![]() ����˫����1��
����˫����1��![]() ����1��
����1��![]() ����1mol(C2H5O)3P=O�����к��е���������������Ŀ��Ϊ25:1����4��P��������Ӧ������һ�ָ�ԭ�Ӿ�����8�����ȶ��ṹ�Ļ�����û�������PCl3��Pԭ�Ӽ۵��Ӷ�����4����1�Թ¶Ե��ӣ���������ӵĿռ乹��Ϊ����������5�����ݾ�̯ԭ����һ����������Geԭ����4������Oԭ������
����1mol(C2H5O)3P=O�����к��е���������������Ŀ��Ϊ25:1����4��P��������Ӧ������һ�ָ�ԭ�Ӿ�����8�����ȶ��ṹ�Ļ�����û�������PCl3��Pԭ�Ӽ۵��Ӷ�����4����1�Թ¶Ե��ӣ���������ӵĿռ乹��Ϊ����������5�����ݾ�̯ԭ����һ����������Geԭ����4������Oԭ������![]() �������ʵĻ�ѧʽΪGeO���������������ԭ�ӵľ���Ϊdpm����߳���
�������ʵĻ�ѧʽΪGeO���������������ԭ�ӵľ���Ϊdpm����߳���![]() ����Ge�����ԭ������Ϊx��
����Ge�����ԭ������Ϊx��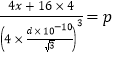 ��x=
��x=![]() ����6��̼̼�����ܴ����ۼ��з����ԣ�����������ԭ�ӽṹ��λ�����ѣ���Ӳ���ࡣ
����6��̼̼�����ܴ����ۼ��з����ԣ�����������ԭ�ӽṹ��λ�����ѣ���Ӳ���ࡣ

 Сѧ��ʱ��ѵϵ�д�
Сѧ��ʱ��ѵϵ�д�