题目内容
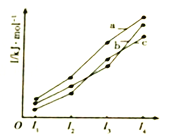
【题目】现有由两种金属元素组成的合金10.5g,投入足量的稀硫酸中反应完全后,测得生成氢气1g,则组成该合金的元素可能是
A. Fe与Zn B. Mg与Cu C. Na与Mg D. Al与Fe
【答案】D
【解析】
分别计算10.5g金属生成氢气的质量,利用平均值法分析。
根据与硫酸反应时铁、锌、镁、铝、钠分别呈+2、+2、+2、+3、+1,10.5g铁与足量稀硫酸反应后生成![]() 0.375g氢气,10.5g锌与足量稀硫酸反应后生成
0.375g氢气,10.5g锌与足量稀硫酸反应后生成![]() 0.323g氢气;10.5g镁与足量稀硫酸反应后生成
0.323g氢气;10.5g镁与足量稀硫酸反应后生成![]() 0.875g氢气;10.5g铝与足量稀硫酸反应后生成
0.875g氢气;10.5g铝与足量稀硫酸反应后生成![]() 1.17g氢气;10.5g钠与足量稀硫酸反应后生成
1.17g氢气;10.5g钠与足量稀硫酸反应后生成![]() 0.457g氢气;铜银不与稀硫酸反应,放出氢气质量为0g,根据平均值法,10.5g合金放出1g氢气,合金中一定有铝,故选D。
0.457g氢气;铜银不与稀硫酸反应,放出氢气质量为0g,根据平均值法,10.5g合金放出1g氢气,合金中一定有铝,故选D。

【题目】某化学学习小组设计了如下从海带灼烧后的海带灰中提取碘单质的流程:
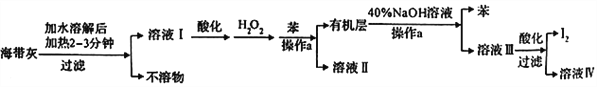
(1)溶解海带灰时要加热煮沸2~3min的目的是_________,操作a的名称是 _______。
(2)向酸化的溶液I中加入H2O2的目的是__________________________________。
(3)已知I2与40%的NaOH溶液反应生成的氧化产物和还原产物的物质的量之比为1:5,则发生反应的化学方程式是________________________________。
(4)最后过滤得到的I2需要进行洗涤和干燥,下列洗涤剂中最应该选用的是______。
a.热水 b.乙醇 c.冷水 d.二硫化碳
(5)用Na2S2O3的标准溶液测定产品的纯度,发生反应:I2+2Na2S2O3=Na2S4O6+2NaI。取5.0g产品,配制成100ml溶液。取10.00ml溶液,以淀粉溶液为指示剂,用浓度为0.050mol·L-1Na2S2O3的标准溶液进行滴定,相关数据记录如下表所示。
编号 | 1 | 2 | 3 |
溶液的体积/mL | 10.00 | 10.00 | 10.00 |
消耗Na2S2O3标准溶液的体积/mL | 19.95 | 17.10 | 20.05 |
滴定时,达到滴定终点的现象是________,碘单质在产品中的质量分数是________% 。