题目内容
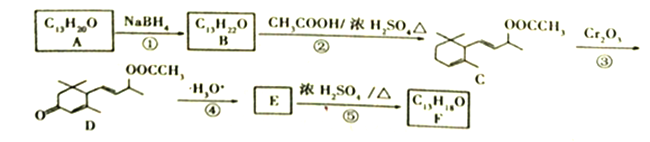
【题目】【题目】工业合成有机物F的路线如下:
已知:①![]() ;
;
②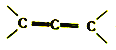 结构不稳定,不子考虑。
结构不稳定,不子考虑。
(1)A中含氧官能团的名称为_______________;C→D反应③的类型为_____________。
(2)化合物B的结构简式为__________;F与Br2按物质的量之比1:1加成所得产物有____种。
(3)E→F的化学方程式为___________________________。
(4)上述转化关系中,设计步骤②和④的目的是______________________________________。
(5)H是A的同分异构体,任写一种满足以下条件的H的结构简式________________。
①与FeCl3溶液发生显色反应。
②核磁共振氢谱有5组峰,且峰面积之比为1:2:2:3:12。
(6)参照上述合成路线,设计并写出用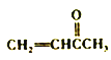 合成聚1.3-丁二烯的路线流程图(无机试剂任选)。 ______________________________
合成聚1.3-丁二烯的路线流程图(无机试剂任选)。 ______________________________
【答案】 羰基 氧化反应 ![]() 4
4  保护羟基防止被CrO3氧化
保护羟基防止被CrO3氧化 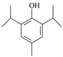 或
或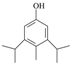
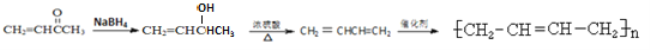
【解析】试题分析:B生成C属于酯化反应,根据C的结构简式,逆推B是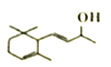 ,A发生还原反应生成B,则A是
,A发生还原反应生成B,则A是![]() ;
;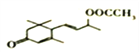 发生水解反应生成E,则E是
发生水解反应生成E,则E是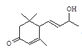 ;
; 在浓硫酸作用下发生氧化反应消去反应生成F,则F是
在浓硫酸作用下发生氧化反应消去反应生成F,则F是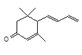 ;
;
解析:根据以上分析,(1)A是![]() ,含氧官能团的名称为羰基;
,含氧官能团的名称为羰基;![]() →
→ 分子中加入了氧原子,去掉了氢原子,所以反应③的类型为氧化反应。(2)化合物B的结构简式为
分子中加入了氧原子,去掉了氢原子,所以反应③的类型为氧化反应。(2)化合物B的结构简式为![]() ;
; 与Br2按物质的量之比1:1加成所得产物有
与Br2按物质的量之比1:1加成所得产物有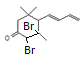 、
、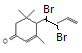 、
、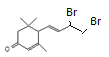 、
、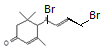 共4种。(3)
共4种。(3) 在浓硫酸作用下发生氧化反应消去反应生成
在浓硫酸作用下发生氧化反应消去反应生成 的化学方程式为
的化学方程式为 。(4)羟基易被氧化,上述转化关系中,设计步骤②和④的目的是保护羟基防止被CrO3氧化。(5)①与FeCl3溶液发生显色反应,说明不含上含有羟基;②核磁共振氢谱有5组峰,且峰面积之比为1:2:2:3:12,结构对称;符合条件的A的同分异构体是
。(4)羟基易被氧化,上述转化关系中,设计步骤②和④的目的是保护羟基防止被CrO3氧化。(5)①与FeCl3溶液发生显色反应,说明不含上含有羟基;②核磁共振氢谱有5组峰,且峰面积之比为1:2:2:3:12,结构对称;符合条件的A的同分异构体是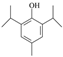 或
或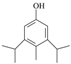 。(6)
。(6)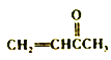 先还原为
先还原为![]() ,
,![]() 在浓硫酸作用下发生氧化反应消去反应生成
在浓硫酸作用下发生氧化反应消去反应生成![]() ,
,![]() 发生加聚反应生成聚1.3-丁二烯,合成路线是
发生加聚反应生成聚1.3-丁二烯,合成路线是![]() 。
。