题目内容
12.设NA是阿伏加德罗常数的值,下列说法正确的是( )| A. | 某温度下纯水的pH=6,该温度下10L pH=11的NaOH溶液中含OH-的数目为NA | |
| B. | 1mol Cl2与足量的铁反应转移的电子数与1mol铁与足量的Cl2反应转移的电子数相等 | |
| C. | 在标准状况下,11.2L NO与11.2L O2混合后所含分子数为0.75NA | |
| D. | 0.5mol•L-1 Na2SO4溶液中含有的阴、阳离子总数为1.5NA |
分析 A.纯水的pH=6,水的离子积为10-12,pH=11的NaOH溶液中氢氧根离子的浓度为0.1mol/L;
B.1mol氯气与足量达到铁反应转移了2mol电子,1mol铁与足量的氯气反应转移了3mol电子;
C.二氧化氮与四氧化二氮存在转化平衡,反应后生成的混合气体的物质的量小于0.75mol;
D.硫酸钠溶液的体积不知,无法计算溶液中硫酸钠的物质的量.
解答 解:A.该温度下水的离子积为10-12,pH=11的NaOH溶液中氢氧根离子的浓度为0.1mol/L,10L该溶液中含有1mol氢氧化钠,含有OH-的数目为NA,故A正确;
B.1molCl2与足量的铁反应转移了2mol电子,1mol铁与足量的Cl2反应转移了3mol电子,二者转移的电子数不相等,故B错误;
C.标况下,11.2L气体的物质的量的为0.5mol,0.5mol一氧化氮消耗0.25mol氧气生成0.0.5mol二氧化氮,反应后气体物质的量为0.75mol,由于存在反应N2O4?2NO2,所以反应后的混合气体的物质的量小于0.75mol,所含分子数小于0.75 NA,故C错误;
D.没有告诉0.5mol/L Na2SO4溶液的体积,无法计算溶液中阴阳离子的物质的量及数目,故D错误;
故选A.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,阿伏加德罗常数是高考的“热点”,它既考查了学生对物质的量、粒子数、质量、体积等与阿伏加德罗常数关系的理解,又可以涵盖多角度的化学知识内容;注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确二氧化氮与四氧化二氮存在转化平衡,为易错点.

练习册系列答案
相关题目
3.光气的分解反应为:COCl2(g)?Cl2(g)+CO(g)△H>0,反应体系达平衡后,各物质的浓度在不同条件下的变化状况如图所示,则下列说法正确的是( )
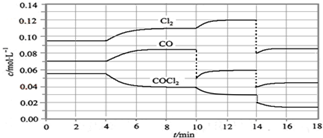

| A. | 从第10 min到第12 min时,生成Cl2的速率v(Cl2)=0.01 mol•L-1•min-1 | |
| B. | 第8 min时与第18 min时反应的平衡常数不相同 | |
| C. | 在第14 min时,改变的条件可能是压缩反应容器的体积 | |
| D. | CO在2-3min、12-13min和16-18min时平均反应速率相等 |
4.76.8mgCu与足量浓硝酸反应,铜作用完全后,如果NO3-减少2×10-3mol,则溶液中H+同时下降( )
| A. | 2.2×10-3mol | B. | 3.2×10-3mol | C. | 4.4×10-3mol | D. | 4.8×10-3mol |
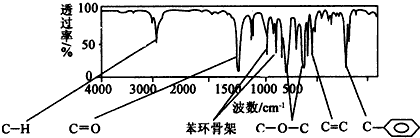
 .
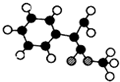
.
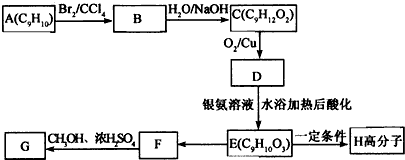
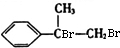 +2NaOH$→_{△}^{水}$
+2NaOH$→_{△}^{水}$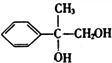 +2NaBr
+2NaBr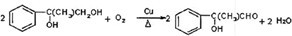
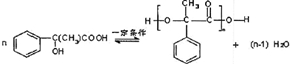
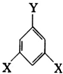 表示(其中X、Y均不为H),试写出符合上述通式且能发生银镜反应的四种物质的结构简式:
表示(其中X、Y均不为H),试写出符合上述通式且能发生银镜反应的四种物质的结构简式: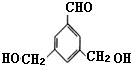 、
、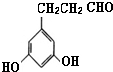 、
、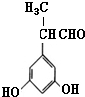 、
、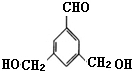 .
.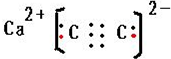 ;制备电石还需要用到CaCO3.组成CaCO3的三种元素的第一电离能按从大到小的顺序排列为O>C>Ca(填元素符号).
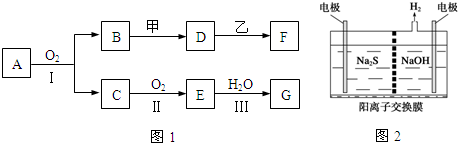
;制备电石还需要用到CaCO3.组成CaCO3的三种元素的第一电离能按从大到小的顺序排列为O>C>Ca(填元素符号).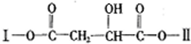 (其中I、II为未知部分的结构)为推测X的分子结构,进行如图的转化:
(其中I、II为未知部分的结构)为推测X的分子结构,进行如图的转化: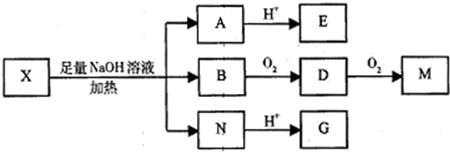
 ;
;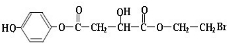 ;
; 开发新能源和三废处理都是可持续发展的重要方面.
开发新能源和三废处理都是可持续发展的重要方面.