题目内容
2.氯碱工业是最基本的化学工业之一,离子膜电解法为目前普遍使用的生产方法,其生产流程如图1所示:
(1)该流程中可以循环的物质是氯化钠、氢氧化钠(或NaCl、NaOH).
(2)电解法制碱的主要原料是饱和食盐水,由于粗盐水中含有Ca2+、Mg2+、SO42-等无机杂质,所以在进入电解槽前需要进行两次精制,写出一次精制中发生的离子方程式Ca2++CO32-=CaCO3↓、Mg2++2OH-=Mg(OH)2↓,若食盐水不经过二次精制,仍会有少量的Ca2+、Mg2+直接进入离子膜电解槽,这样产生什么后果是少量Mg2+、Ca2+在电解碱性条件下会生成沉淀,损害离子交换膜.
(3)图2是工业上电解饱和食盐水的离子交换膜电解槽示意图(阳极用金属钛网制成,阴极由碳钢网制成).则B处产生的气体是H2,E电极的名称是阳极.电解总反应的离子方程式为2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH-.
(4)从阳极槽出来的淡盐水中,往往含有少量的溶解氯,需要加入8%~9%的亚硫酸钠溶液将其彻底除去,该反应的化学方程式为Na2SO3+Cl2+H2O=Na2SO4+2HCl.
(5)已知在电解槽中,每小时通过1安培的直流电理论上可以产生1.492g的烧碱,某工厂用300个电解槽串联生产8小时,制得32%的烧碱溶液(密度为1.342吨/m3)113m3,电解槽的电流强度1.45×104A,该电解槽的电解效率为93.46%.
分析 (1)根据工艺流程图结合电解工艺的原料以及产物知识来判断;
(2)除去钙离子使用碳酸钠试剂,除去镁离子使用氢氧化钠试剂,根据处理后的盐水中还含有少量杂质离子对装置的影响角度来回答;
(3)电解池中,阳离子移向阴极,根据电极反应确定产物,根据电解池的工作原理来书写方程式;
(4)氯气具有氧化性,能将亚硫酸钠氧化为硫酸钠;
(5)计算生成NaOH的质量,根据理论耗电量和实际耗电量计算.
解答 解:(1)根据工艺流程图结中用到的原料以及产物,可以知道从阳极槽出来的淡盐水中含有氯化钠可以循环使用,电解产生的氢氧化钠可作为在进入电解槽前需要进行两次精制的原料,也是可以循环使用的物质,
故答案为:氯化钠、氢氧化钠;
(2)除去钙离子使用碳酸钠试剂,Ca2++CO32-=CaCO3↓除去镁离子使用氢氧化钠试剂,Mg2++2OH-=Mg(OH)2↓,若食盐水不经过二次精制,处理后的盐水中还含有少量杂质离子Mg2+、Ca2+,碱性条件下会生成沉淀,对装置中的交换膜产生影响,
故答案为:Ca2++CO32-=CaCO3↓、Mg2++2OH-=Mg(OH)2↓,用试剂处理后的盐水中还含有少量Mg2+、Ca2+,碱性条件下会生成沉淀,损害离子交换膜;
(3)电解池中,阳离子钠离子移向阴极,所以B是电源的负极,A是正极,E是阳极,在阴极上产生的是氢气,电解饱和食盐水的原理方程式为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH-,
故答案为:H2;阳极;2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH-;
(4)氯气具有氧化性,能将亚硫酸钠氧化为硫酸钠,即Na2SO3+Cl2+H2O=Na2SO4+2HCl,
故答案为:Na2SO3+Cl2+H2O=Na2SO4+2HCl;
(5)烧碱溶液质量为1.342×103kg/m3×113m3=1.516×105kg,
m(NaOH)=1.516×105kg×32%=4.85×104kg,
则理论上需要电流量为$\frac{4.85×1{0}^{7}g}{1.492g}$=3.252×107A,
则实际上耗电量为1.45×104A×8×300=3.48×107A,
该电解槽的电解效率为$\frac{3.252}{3.48}$×100%=93.45%,
故答案为:93.45%.
点评 本题以氯碱工业为载体,考查学生生化学工艺流程题的解题方法知识,注意电解池的工作原理的灵活应用是关键,题目难度中等.

| A. | 某温度下纯水的pH=6,该温度下10L pH=11的NaOH溶液中含OH-的数目为NA | |
| B. | 1mol Cl2与足量的铁反应转移的电子数与1mol铁与足量的Cl2反应转移的电子数相等 | |
| C. | 在标准状况下,11.2L NO与11.2L O2混合后所含分子数为0.75NA | |
| D. | 0.5mol•L-1 Na2SO4溶液中含有的阴、阳离子总数为1.5NA |
| A. | 用足量的氢氧化钠溶液吸收二氧化氮:3NO2+2OH-═2NO3-+NO+H2O | |
| B. | 用过量的氨水吸收烟道气中的SO2:SO2+2NH3•H2O=2NH4++SO32-+H2O | |
| C. | NH4Al(SO4)2溶液与过量NaOH溶液混合加热:NH4++Al3++4OH-═Al(OH)3↓+NH3↑+H2O | |
| D. | 向酸性KMnO4溶液中通入SO2:2MnO4-+5SO2+4OH-═2Mn2++5SO42-+2H2O |
| A. | 14 g C2H4中含有2NA个C-H键 | |
| B. | 1 mol•L-1 NH3•H2O溶液中含有NA个NH4+ | |
| C. | 1 mol Na2O2和足量CO2反应产生NA个O2分子 | |
| D. | 常温常压下,22.4 L 的SO2中含有NA个SO2分子 |
| A. | 用丙烷和水蒸气高温下反应制取氢气,每产生0.3molCO,同时产生0.7NA个H2分子 | |
| B. | 常温常压下,16 g O3所含的电子数为8NA | |
| C. | 标准状况下 11.2 L NO与11.2 L O2混合,充分反应后所含分子数小于0.75NA | |
| D. | 1 mol/L的Ca(ClO)2溶液中含ClO-数目一定小于2NA |
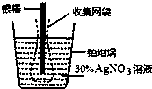 下图为根据电解原理制成“银电量计”.其原理是:通过测定电解过程中附着在惰性电极上金属质量,计算通过电解池的电量.下列说法正确的是( )
下图为根据电解原理制成“银电量计”.其原理是:通过测定电解过程中附着在惰性电极上金属质量,计算通过电解池的电量.下列说法正确的是( )| A. | 电量计工作时溶液里的阴离子向正极移动 | |
| B. | 电量计工作时银棒应与电源的正极相连 | |
| C. | 网袋是收集银溶解过程中产生的金属颗粒,若没有该网袋,测量结果会偏低 | |
| D. | 若得金属银的沉积量为1.08g,则电解过程中转移的电子为0.01mol |
| A. | 15g甲基(-CH3)所含有的电子数是10NA | |
| B. | 常温常压下,30g甲醛所含有的原子数目为4NA | |
| C. | 标准状况下,1L戊烷充分燃烧后生成的气态产物的分子数为5/22.4 NA | |
| D. | 常温常压下,1mol丙烷所含有的共价键数目为12NA |
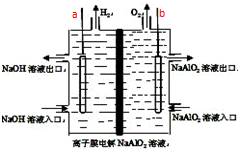 工业上利用离子膜电解偏铝酸钠溶液制备高品质的氢氧化铝,装置如图所示(a、b为电源的电极):该电池的总反应方程式为:4NaAlO2+10H2O$\frac{\underline{\;通电\;}}{\;}$ 4Al(OH)3↓+4NaOH+O2↑+2H2↑.电解池阳极室发生的电极反应式是4AlO2-+6H2O-4e-=4Al(OH)3↓+O2↑,该离子膜为阳离子交换膜(填“阴”或“阳”)
工业上利用离子膜电解偏铝酸钠溶液制备高品质的氢氧化铝,装置如图所示(a、b为电源的电极):该电池的总反应方程式为:4NaAlO2+10H2O$\frac{\underline{\;通电\;}}{\;}$ 4Al(OH)3↓+4NaOH+O2↑+2H2↑.电解池阳极室发生的电极反应式是4AlO2-+6H2O-4e-=4Al(OH)3↓+O2↑,该离子膜为阳离子交换膜(填“阴”或“阳”)