题目内容
15.现有五种可溶性物质A、B、C、D、E,它们所含的阴、阳离子互不相同,分别含有五种阳离子Na+、Al3+、Mg2+、Ba2+、Fe3+和五种阴离子Cl-、OH-、NO3-、CO32-、X中的一种.(1)某同学通过分析比较,认为无需检验就可判断其中必有的两种物质是Na2CO3和Ba(OH)2.(填化学式)
(2)为了确定X,现将(1)中的两种物质记为A和B,当C与B的溶液混合时,产生红褐色沉淀和无色无味气体;当C与A的溶液混合时产生棕色沉淀,向该沉淀中滴入稀硝酸,沉淀部分溶解,最后留有白色沉淀不再溶解.则:①X为B.
A.SO32- B.SO42-C.CH3COO- D.SiO32-
②现需要200mL 0.1mol/L的A溶液,需用托盘天平称取A固体的质量为3.4g,配制溶液时,所需要的玻璃仪器除玻璃棒、烧杯外,还需要250mL容量瓶、胶头滴管.
③利用上述已经确定的物质,可以检验出D、E中的阳离子.请简述实验操作步骤、现象及结论分别取适量的D、E溶液于两支试管中,分别滴加过量的Ba(OH)2溶液,产生白色沉淀的含有Mg2+,产生白色沉淀后又溶解的含有Al3+.
(3)将Cu投入到装有D溶液的试管中,Cu不溶解;再滴加稀硫酸,Cu逐渐溶解,管口附近有红棕色气体出现.则物质D一定含有上述离子中的NO3-(填相应的离子符号).
分析 因阳离子中Al3+、Mg2+、Ba2+、Fe3+均不能与CO32-共存,所以CO32-只能与Na+结合成Na2CO3存在,又因Al3+、Mg2+、Fe3+均不能与OH-共存,所以OH-只能与Ba2+结合成Ba(OH)2存在,由(2)可知,当C与B的溶液混合时,产生红褐色沉淀和无色无味气体,很明显是Fe3+与CO32-发生双水解的现象,不难得出B为Na2CO3,A为Ba(OH)2,C中有Fe3+,又因C与A反应产生的白色沉淀不溶于稀HNO3,则C为Fe2(SO4)3,结合对应物质的性质以及题目要求可解答该题.
解答 解:(1)因阳离子中Al3+、Mg2+、Ba2+、Fe3+均不能与CO32-共存,所以CO32-只能与Na+结合成Na2CO3存在,又因Al3+、Mg2+、Fe3+均不能与OH-共存,所以OH-只能与Ba2+结合成Ba(OH)2存在,则必有Na2CO3、Ba(OH)2,
故答案为:Na2CO3;Ba(OH)2;
(2)①当C与B的溶液混合时,产生红褐色沉淀和无色无味气体,很明显是Fe3+与CO32-发生双水解的现象,不难得出B为Na2CO3,A为Ba(OH)2,C中有Fe3+,又因C与A反应产生的白色沉淀不溶于稀HNO3,则C为Fe2(SO4)3,
故答案为:B;
②现需要200mL 0.1mol/L的A溶液,A为Ba(OH)2 ,溶液中氢氧化钡的质量=0.200L×0.1mol/L×171g/mol=3.42g,托盘天平的精确度为0.1g,需用托盘天平称取A固体的质量为3.4g,配制溶液时,所需要的玻璃仪器除玻璃棒、烧杯外,还需要200ml的容量瓶,定容需要的胶头滴管,
故答案为:3.4;250mL容量瓶、胶头滴管;
③D,E中的阳离子为Al3+、Mg2+,检验Al3+,可逐渐加入Ba(OH)2溶液直至过量,若先出现白色沉淀后又逐渐溶解,往D、E的溶液中逐渐加入Ba(OH)2溶液直至过量,若先出现白色沉淀后又逐渐溶解,则D中含有Al3+,若出现白色沉淀则说明E中含有Mg2,
故答案为:分别取适量的D、E溶液于两支试管中,分别滴加过量的Ba(OH)2溶液,产生白色沉淀的含有Mg2+,产生白色沉淀后又溶解的含有Al3+;
(3)将Cu投入到装有D溶液的试管中,Cu不溶解;再滴加稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现,说明D中含有的阴离子应具有强氧化性,应为NO3-,反应的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,
故答案为:NO3-.
点评 本题考查离子的共存,明确常见物质的溶解性来判断必须存在的物质是解答本题的关键,运用假设法和排除法进行筛选,即可判断出几种离子的组合,注意掌握离子性质和反应现象的分析判断,本题难度较大,考查学生的综合运用知识的能力.

 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案| A. | pH=1 | B. | pH≥1 | C. | pH≤1 | D. | 无法确定 |
| A. | 240 mL 0.2 mol•L-1的NaOH溶液配制:需要使用天平、烧杯、250 mL容量瓶等仪器 | |
| B. | 除去Cu粉中的CuO,可向混合物中滴加适量稀硫酸再过滤 | |
| C. | 为增强氯水的漂白性,向其中加入碳酸钙 | |
| D. | 为使0.5mol/L的NaNO3溶液物质的量浓度变为1mol/L,可将原溶液加热蒸发掉50克水 |
| A. | 置换出金属铜 | B. | 产生气体,置换出金属铜 | ||
| C. | 只生成蓝色沉淀 | D. | 产生气体,生成蓝色沉淀 |
| A. | MgSO4 溶液与Ba(OH)2溶液反应:SO42-+Ba2+═Ba SO4↓ | |
| B. | 钠与水的反应:2Na+2H2O═2Na++2OH-+H2↑ | |
| C. | 铝片与氢氧化钠溶液反应:2Al+2OH--+2H2O═AlO2-+3H2↑ | |
| D. | 氢氧化铁溶于氢碘酸中Fe(OH)3+3H+═Fe3++3H2O |
| A. | 1 mo1 N2和3 mol H2在一定条件下的密闭容器中充分反应,容器内的分子数2NA | |
| B. | 1 mol•L-1 FeCl3溶液中所含Cl-的数目为3NA | |
| C. | 标准状况下,22.4L14CO2与44g14CO2所含分子数均为NA | |
| D. | 标准状况下,16 g O3和O2混合气体中含有的氧原子数为NA |
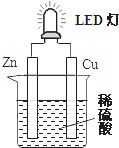
| A. | 铜片表面有气泡生成,且铜片为正极,为电子流入的一极 | |
| B. | 如果将硫酸换成苹果汁,导线中不会有电子流动 | |
| C. | 装置中存在“化学能→电能→光能”的转换 | |
| D. | 如果将锌片换成铁片,电路中的电流方向由铜片经导线流向铁片,铁片发生氧化反应 |
 乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4•xH2O)进行的探究性学习
乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4•xH2O)进行的探究性学习