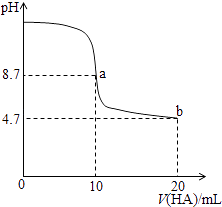
��Ŀ����
����Ŀ��SO2����Ϊ��ɫ���壬��ǿ�Ҵ̼�����ζ��������Ҫ��Ⱦ��֮һ��ijѧϰС��Ϊ��̽�����������ijЩ���ʣ�����������ʵ�顣
I.����ͼ��ʾ��ʹ��ҩƷ��װ��һ̽����������Ļ�ԭ��:
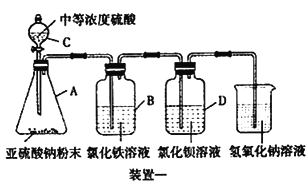
��1��װ��C������Ϊ________��
��2��B����Һ������Ϊ________��
��3��ѧ����Ԥ��װ��D ��û�а�ɫ���������������ŷ�Ӧ�Ľ��У�����D �в�����������ɫ������ѧ���Ҿ����������Ϸ���������ɫ�������������ᱵ����Ϊװ�û���Һ������������������������Ӧ����д��װ��D �еķ�Ӧ����ʽ________��
II.����˼�������������װ�ö����������Ƶ���Һ��ʹ����������ˮ������SO2 ����������ʱ���Ƿ����Ȼ�����Ӧ���ɳ�����
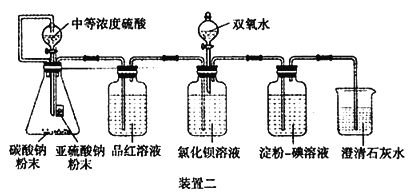
��4��̼���Ʒ�ĩ��Ŀ����________��
��5����______ʱ���Ȼ�����Һ��û�г������֣�˵�������������Ȼ�����Һ��Ӧ����ʱ�μ�˫��ˮ�������˰�ɫ������
��6���b�ö�ѡ�ó���ʯ��ˮ����������������Һ��Ŀ����________��
���𰸡� ��Һ©�� ��Һ���ػ�ɫ��Ϊdz��ɫ 2SO2+O2+2BaCl2+2H2O=2BaSO��+4HCl ����������̼,�ų�װ���е����� ������-����Һ��ɫ��ȥ(ֻ���Ʒ����ɫ������) ���������̼�Ƿ����ž�װ���еĿ���(�����ʯ��ˮ�����,֤��װ���п�����ȫ���ϳ������������𰸸���,ֻ�����ȥ�����SO2������)
����������1��װ��CΪ��Һ©����
��2��A�����ɶ��������������B�У���������Ὣ�Ȼ�����ԭΪ�Ȼ����������Կ���������Ϊ��Һ���ػ�ɫ��Ϊdz��ɫ��
��3����Ŀ��Ϊ�ǣ�װ�û���Һ������������������������Ӧ����һ����������+4��S����Ϊ+6�ۣ���Ӧ��һ����SO2��O2��BaCl2��������һ�������ᱵ��������ôClԪ��ֻ����HCl����ʽ���ڣ����Է�ӦΪ��Ҫ����H2O�����Է�ӦΪ2SO2 + O2 + 2BaCl2 + 2H2O = 2BaSO4��+ 4HCl��
��4��װ����Ҫ�ų�������������̼���ƺ����ᷴӦ�����ɵĶ�����̼���ſ�����
��5��������-����Һ��ɫ��ȥʱ��˵�����������Ѿ��������-����Һ�������Ȼ�����������˵�������������Ȼ�����Һ��Ӧ��ע�⣺��Ʒ����ɫ�Dz������ģ���Ϊ���ܶ����������ʹƷ����ɫ����δ�����Ȼ�����Һ��
��6����������������Һ����Ҫ������ָʾװ�õĿ����Ѿ��������ˣ�����������������Һ�л��ǣ�����������̼�����Ѿ����������ձ��У�װ���еĿ������ž���