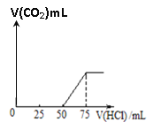
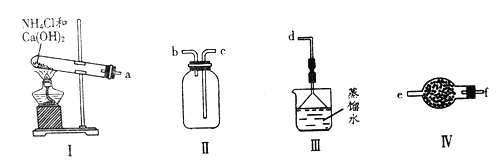
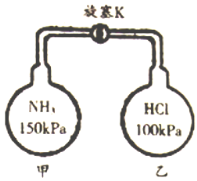
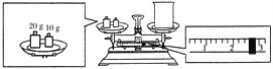
题目内容
【题目】常温下,将0.1mol/LNaOH溶液分别滴加到0.1mol/LHA溶液和HB溶液中,两混合溶液中离子浓度与pH的变化关系如图所示,下列说法不正确的是
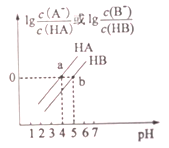
A. Ka(HB)<Ka(HA)
B. a点时,c(A-)=c(HA)>c(Na+)>c(H+)>c(OH-)
C. 常温下,0.1mol/LNaA溶液的pH大于0.1mol/LNaB溶液的pH
D. 向HB溶液中加入NaOH溶液,混合溶液中c(B-)/c(HB)=10[pH-pKa(HB)](已知:pKa=-lgKa)
【答案】C
【解析】A.根据a点信息,可知pH=4时,lg![]() =0,即
=0,即 ![]() =1。所以 Ka(HA)=
=1。所以 Ka(HA)=![]() =c(H+)=10-4;同理,根据b点信息,可得 Ka(HB)=10-5;所以Ka(HB)<Ka(HA),故A正确;B.根据a点信息,pH=4,溶液呈酸性,c(H+)>c(OH-), lg
=c(H+)=10-4;同理,根据b点信息,可得 Ka(HB)=10-5;所以Ka(HB)<Ka(HA),故A正确;B.根据a点信息,pH=4,溶液呈酸性,c(H+)>c(OH-), lg![]() =0,则c(A-)=c(HA),根据电荷守恒c(A-)+c(OH-)=c(Na+)+c(H+),由c(H+)>c(OH-),可推出c(A-)>c(Na+),所以c(A-)=c(HA)>c(Na+)>c(H+)>c(OH-);C.根据a点信息可知,Ka(HB)<Ka(HA),越弱越水解,溶液pH越大,故C错误;D.根据Ka(HB)=
=0,则c(A-)=c(HA),根据电荷守恒c(A-)+c(OH-)=c(Na+)+c(H+),由c(H+)>c(OH-),可推出c(A-)>c(Na+),所以c(A-)=c(HA)>c(Na+)>c(H+)>c(OH-);C.根据a点信息可知,Ka(HB)<Ka(HA),越弱越水解,溶液pH越大,故C错误;D.根据Ka(HB)=![]() ,c(B-)/c(HB)=
,c(B-)/c(HB)=![]() =10[pH-pKa(HB)],故D正确;
=10[pH-pKa(HB)],故D正确;

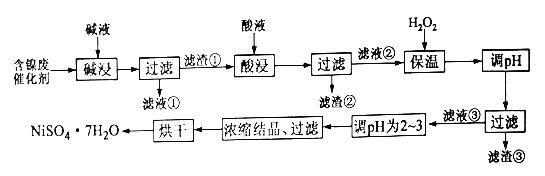
【题目】某化工厂的含镍催化剂主要含有镍、铝、铁单质及它们的氧化物,还有部分不溶于酸和碱的杂质。为了从含镍催化剂中回收镍,设计了如下的工艺流程:
部分阳离子完全沉淀时溶液的pH如下:
沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
pH | 5.2 | 3.2 | 9.7 | 9.2 |
回答如下问题:
(1)碱浸的目的是为了除去____________
(2)某学习小组在实验室中模拟上述流程,简述洗涤滤渣①的操作_________
(3)加入H2O2并保温一段时间过程中,保温的温度不宜过高的原因为______,加入H2O2发生反应的离子方程式为___________。加入H2O2保温后调pH,下列范围合理的是______(填选项序号)。
A.1.8~3.2 B.2.0~3.0 C.3.3~5.2 D.9.2~9.7
(4)滤渣③的主要成分为_______,滤液③调pH为2~3的目的为________
(5)为测定产品中NiSO4·7H2O纯度,某同学将一定量的样品溶于水,再向其中加入足量的BaCl2溶液,过滤、洗涤沉淀并干燥,称量质量。通过计算发现产品中NiSO4·7H2O的质量分数大于100%,其可能的原因为____________________