��Ŀ����
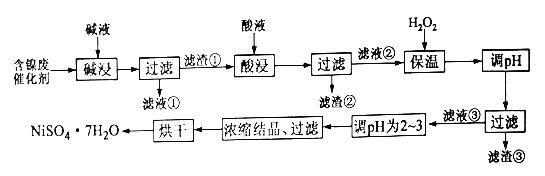
����Ŀ��ij�������ĺ���������Ҫ�����������������ʼ����ǵ���������в��ֲ�������ͼ�����ʡ�Ϊ�˴Ӻ��������л���������������µĹ�������:
������������ȫ����ʱ��Һ��pH����:
������ | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
pH | 5.2 | 3.2 | 9.7 | 9.2 |
�ش���������:
(1)�����Ŀ����Ϊ�˳�ȥ____________
(2)ijѧϰС����ʵ������ģ����������,����ϴ�������ٵIJ���_________
(3)����H2O2������һ��ʱ������У����µ��¶Ȳ��˹��ߵ�ԭ��Ϊ______,����H2O2������Ӧ�����ӷ���ʽΪ___________������H2O2���º��pH,���з�Χ��������______(��ѡ�����)��
A.1.8~3.2 B.2.0~3.0 C.3.3~5.2 D.9.2~9.7
(4)�����۵���Ҫ�ɷ�Ϊ_______,��Һ�۵�pHΪ2~3��Ŀ��Ϊ________
(5)Ϊ�ⶨ��Ʒ��NiSO4��7H2O���ȣ�ijͬѧ��һ��������Ʒ����ˮ,�������м���������BaCl2��Һ,���ˡ�ϴ�ӳ���������,����������ͨ�����㷢�ֲ�Ʒ��NiSO4��7H2O��������������100%,����ܵ�ԭ��Ϊ____________________
���𰸡� Al��Al2O3 ��©���м���������ˮ��û�����٣���ˮ��Ȼ���º��ظ���������2��3�� �¶ȸߣ���ʹH2O2���ٷֽ⣬����ԭ�������� H2O2 + 2Fe2+ + 2H+ == 2Fe3+ + 2H2O C Fe(OH)3 ��Ũ���ᾧ�����з�ֹNi2+ˮ�� ���ʱʧȥ�˲��ֽᾧˮ
�����������������������Ϊ�˳�ȥ�����������K����֬,��������Ԫ�غ�ǿ�Ӧ,�������������������ǿ�Ӧ,�����ʺ������������ﲻ�ͼӦ�ﵽ��ȥ��Ԫ�ص�Ŀ��;��Ӧ�����ַ���ʽΪ:2Al+2OH-+2H2O=2AlO2-+3H2����Al2O3+2OH-=2AlO2-+3H2O����ˣ�������ȷ����:Al��Al2O3����֬��
(2)ϴ�������ٵIJ�������©���м���������ˮ��û�����٣���ˮ��Ȼ���º��ظ���������2��3�Σ�
��3������H2O2������һ��ʱ������У����µ��¶Ȳ��˹��ߵ�ԭ��Ϊ�¶ȸߣ���ʹH2O2���ٷֽ⣬����ԭ�������ʣ�����H2O2������������Fe2+����Fe3+�����ݵ����غ��ԭ���غ㣬������Ӧ�����ӷ���ʽΪH2O2 + 2Fe2+ + 2H+ == 2Fe3+ + 2H2O������H2O2���º��pH������Χ��3.3![]() 5.2��ȷ��Fe3+������ȫ��
5.2��ȷ��Fe3+������ȫ��
(4)������ͼ֪�������۵���Ҫ�ɷ�ΪFe(OH)3 ,��Һ�۵�pHΪ2![]() 3��Ŀ��Ϊ��Ũ���ᾧ�����з�ֹNi2+ˮ�⣻
3��Ŀ��Ϊ��Ũ���ᾧ�����з�ֹNi2+ˮ�⣻
(5)�ֲ�Ʒ��NiSO4��7H2O��������������100������ԭ������Ǻ��ʱʧȥ�˲��ֽᾧˮ��

����Ŀ���÷��Ѵ���Ϊԭ��ұ����������һ�ֹ�����ϣ���Ҫ�ɷ����±���
���� | TiO2 | MgO | SiO2 | CaO | Al2O3 |
�����ٷֺ���/% | 51.00 | 12.52 | 5.39 | 4.00 | 19.34 |
ͨ�����й������̿���ʵ��Ԫ��Ti��Al�� Si�Ļ������ã����õ����������Ѻͷ���ɸ��

��ش��������⣺
(1)����٢ڢ��н��з��������������_____________________��
(2)���й�����ϵijɷ��У������ڼ������������___________________(����ĸ���)��
a.TiO2 b.MgO c.SiO2 d.CaO
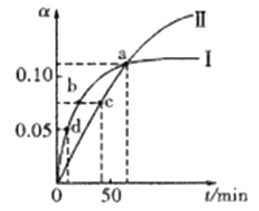
(3)�����¶Ⱥ��ѵ���ȡ�ʹ�ϵ����ͼ�������¶�Ϊ500�棬����__________________��

(4)��Һ�������ʵijɷ���_______________________��
(5)������з�����Ӧ�����ӷ���ʽ��___________________________��
(6)�����������ȡ����ɸ�Ļ�ѧ����ʽ����������_______
��____+6Na2SiO3+8H2O=Na8Al6Si6O24(OH)2��2H2O+��
���ݳɷֱ������ݣ�����10kg������ϣ�������Ӧ�ټ���Na2SiO3���ʵ����ļ���ʽ��n(Na2SiO3)=______mol (Ħ������/g/mol��SiO2 60 Al2O3 102)��