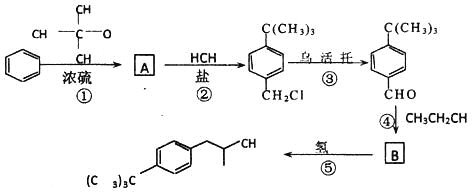
题目内容
【题目】有A、B、C、D、E、F、G七种元素,除E为第四周期元素外其余均为短周期元素。A、E、G位于元素周期表的s区,其余元素位于p区,A、E的原子外围电子层排布相同,A的原子中没有成对电子;B元素基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;C元素原子的外围电子层排布式为nsnnpn+1;D元素单质的氧化性在同周期主族元素的单质中排第二位;F的基态原子核外成对电子数是单电子数的3倍;G的基态原子占据两种形状的原子轨道,且两种形状轨道中的电子总数均相同。回答下列问题:
(1)写出下列元素的符号:D________,G________。
(2)E元素位于周期表________区,________族。
(3)写出C的电子排布式:________。
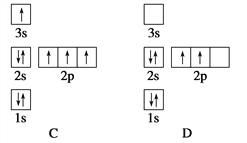
(4)B的原子结构示意图为________。
(5)基态A原子中含有的未成对电子数为________。
【答案】 S Mg s ⅠA 1s22s22p3 ![]() 1
1
【解析】
ABCDEF、G七种元素,除E为第4周期元素外其余均为短周期元素,A、E、G位于元素周期表的s区,AE的原子外围电子层排布相同,A的原子中没有成对电子,则A为H,E为第四周期第ⅠA族元素,即E为K;BCDF元素位于p区,C元素原子的外围电子层排布式为nsnnpn+1,n=2时符合,则C为N元素;B元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子总数相同,电子排布为1s22s22p2,则B为C元素;D元素单质的氧化性在同周期主族元素的单质中排第二,D排在N元素之后则D为S;F的基态原子核外成对电子数是成单电子数的3倍,F的原子序数比C元素的大,其电子排布为1s22s22p4,即F为O元素,G的基态原子占据两种形状的原子轨道,且两种形状轨道中的电子总数相同,G位于元素周期表的s区,则G电子排布式为1s22s22p63s2,则G为Mg元素。
(1)根据以上推断可知,D为S,G为Mg;
(2)E为K元素,价层电子排布为:4s1,因此E属于s区,ⅠA;
(3)C为N元素,则C的电子排布式为:1s22s22p3;
(4)B为C元素,原子结构示意图为: ;
;
(5)A为H元素,基态H原子中含有的为成对电子数为1。

 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案【题目】用钒钛磁铁为原料冶炼铁,产生一种固体废料,主要成分如下表。
物质 | TiO2 | MgO | SiO2 | CaO | Al2O3 |
质量百分含量/% | 51.00 | 12.52 | 5.39 | 4.00 | 19.34 |
通过下列工艺流程可以实现元素Ti、Al、 Si的回收利用,并得到纳米二氧化钛和分子筛。

请回答下列问题:
(1)步骤①②③中进行分离操作的名称是_____________________。
(2)下列固体废料的成分中,不属于碱性氧化物的是___________________(填字母序号)。
a.TiO2 b.MgO c.SiO2 d.CaO
(3)熔融温度和钛的提取率关系如下图,适宜温度为500℃,理由__________________。

(4)滤液①中溶质的成分是_______________________。
(5)步骤②中发生反应的离子方程式是___________________________。
(6)将步骤③中制取分子筛的化学方程式补充完整:_______
□____+6Na2SiO3+8H2O=Na8Al6Si6O24(OH)2·2H2O+□
根据成分表中数据,计算10kg固体废料,理论上应再加入Na2SiO3物质的量的计算式是n(Na2SiO3)=______mol (摩尔质量/g/mol:SiO2 60 Al2O3 102)。