��Ŀ����
����Ŀ��ȡһ�����ʵ���Ũ�ȵ�NaOH��Һ100mL��Ȼ������ͨ��һ������CO2���壬�õ���ҺA����A����λ�������0.1mol/L��HCl��Һ��������CO2�����������״����������HCl��Һ�����֮���ϵ��ͼ��ʾ��ͨ������ش�
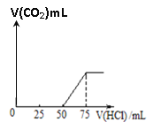
��1��A��Һ�е�����Ϊ_________����ѧʽ���������ʵ���֮����_______��
��2��ͨ��CO2�������__________________����״������
��3��NaOH��Һ�����ʵ���Ũ��______________________��
��4������ͨ���CO2����Ϊ112mL, �����õ���Һ��λ�������0.1mol/L��HCl��Һ������������CO2�����������״�����Ĺ�ϵͼ________________����Ӧ���ֹؼ�������ݣ�
���𰸡�NaOH��Na2CO3 1��1 56 mL 0.075mol/L 
��������
��1��CO2��NaOH��Һ��Ӧ���������֡��߽硱�������CO2+2NaOH= Na2CO3+H2O���� CO2+NaOH=NaHCO3���ʷ�Ӧ����Һ�����ʵijɷֿ������¿��ܣ�Na2CO3��NaOH��Na2CO3��Na2CO3��NaHCO3��NaHCO3������ϡ������εε�̼������Һ��ʱ��Na2CO3������ķ�Ӧ�Ƿֲ����еģ�Na2CO3+HCl=NaHCO3+NaCl��, NaHCO3+HCl=NaCl+H2O+CO2���ܣ����ҿ��Կ���������Ӧ��ȫ����ʱ��������������HCl������ȣ�����Һ�л����������ƣ������ȷ�����Ӧ��NaOH+HCl=NaCl+H2O �ݣ��跴Ӧ����CO2֮ǰ������������ΪV1���ӿ�ʼ����CO2����Ӧ����������������ΪV2�������ַ�Ӧ������ܽ������

���ͼ����з������⣨1����2����3����
��4��������̼����������ǡ����ȫ��Ӧ����̼���ƺ�̼�����Ʒ�Ӧ������̼ԭ�ӡ��������غ��з��̣����̼���ƺ�̼�����Ƶ����ʵ��������Һ�м������ᣬ̼���ƺ����ᷴӦ����̼�����ƣ�ԭ�еĺ������ɵ�̼���������������ᷴӦ���ɶ�����̼���������������̼�����������ݴ˻�����Ӧ��ͼ��
CO2��NaOH��Һ��Ӧ���������֡��߽硱�������CO2+2NaOH= Na2CO3+H2O�� �� CO2+NaOH=NaHCO3���ʷ�Ӧ����Һ�����ʵijɷֿ������¿��ܣ�Na2CO3��NaOH��Na2CO3��Na2CO3��NaHCO3��NaHCO3������ϡ������εε�̼������Һ��ʱ��Na2CO3������ķ�Ӧ�Ƿֲ����еģ�Na2CO3+HCl=NaHCO3+NaCl��, NaHCO3+HCl=NaCl+ H2O+CO2���ܣ����ҿ��Կ���������Ӧ��ȫ����ʱ��������������HCl������ȣ�����Һ�л����������ƣ������ȷ�����Ӧ��NaOH+HCl=NaCl+H2O �ݣ��跴Ӧ����CO2֮ǰ������������ΪV1���ӿ�ʼ����CO2����Ӧ����������������ΪV2�������ַ�Ӧ������ܽ������

�������е�ͼ��
��1��V1=50��V2=50-25=25mL<V1���ݴ��ж���Һ�����ʵijɷ���NaOH��Na2CO3�����������ݢۢ�������ѧ����ʽ��֪��n(NaOH)��n(Na2CO3)=(75-50):25=1:1��
�������������������NaOH��Na2CO3��1:1��
��2��50mL~75mL�����ķ�ӦΪHCO3-+H+=H2O+CO2����n(HCl)=0.025��0.1=0.0025mol�����ݷ�Ӧ��ϵ��֪��V(CO2)=0.0025��22.4=0.056L=56mL��
�������������������56 mL��
��3������������75mLʱ����Һ����ΪNaCl����ʱn(Na+)= n(HCl)=0.075��0.1=0.0075mol������n(NaOH)=0.0075mol,c(NaOH)=0.0075/0.1=0.075mol/L��
�������������������0.075mol/L��
��4��CO2����Ϊ112mL�����ʵ���Ϊ0.005mol�����������Ʒ�����Ӧ����̼���ƺ�̼�����ƣ�������̼����Ϊxmol������̼������Ϊymol������̼ԭ���غ㣺x+y=0.005mol,�������غ㣺2x+y=0.075��0.1=0.0075��ͨ�������֪x=0.0025mol��y=0.0025mol��̼���ƺ�̼�����ƵĻ��Һ�м������ᣬ̼���������ᷴӦ����̼�����ƣ�����Na2CO3+HCl=NaHCO3+NaCl��֪��������������Ϊ��V(HCl)=0.0025/0.1=0.025L=25mL�����ɵ�̼�����ƺ�ԭ�е�̼�����ƹ���0.0025+0.0025=0.005mol������NaHCO3+HCl=NaCl+ H2O+CO2����Ӧ��֪�����ɶ�����̼�����Ϊ��0.005��22.4=0.112L=112mL�������Ϸ������Ի���̼���ƺ�̼�����ƻ����Һ����λ�������0.1mol/L��HCl��Һ����������CO2�����������״�����Ĺ�ϵͼ���£�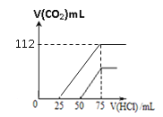 ������������������ǣ�
������������������ǣ� ��
��

 ȫ�ſ��䵥Ԫ�����������ܸ�ϰϵ�д�
ȫ�ſ��䵥Ԫ�����������ܸ�ϰϵ�д� Ʒѧ˫�ž�ϵ�д�
Ʒѧ˫�ž�ϵ�д�