题目内容
【题目】甲酸![]() 是还原性酸,又称作蚁酸,常用于橡胶、医药、染料、皮革等工业生产。某化学兴趣小组在分析甲酸的组成和结构后,对甲酸的某些性质进行了探究。请回答下列问题。
是还原性酸,又称作蚁酸,常用于橡胶、医药、染料、皮革等工业生产。某化学兴趣小组在分析甲酸的组成和结构后,对甲酸的某些性质进行了探究。请回答下列问题。

Ⅰ.甲酸能与醇发生酯化反应
该兴趣小组用如上图所示装置进行甲酸![]() 与甲醇
与甲醇![]() 的酯化反应实验:
的酯化反应实验:
有关物质的性质如下:
沸点/℃ | 密度 | 水中溶解性 | |
甲醇 | 64.5 | 0.79 | 易溶 |
甲酸 | 100.7 | 1.22 | 易溶 |
甲酸甲酯 | 31.5 | 0.98 | 易溶 |
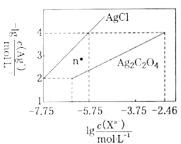
(1)装置中,仪器A的名称是__________,长玻璃管c的作用是__________、__________
(2)甲酸和甲醇进行酯化反应的化学方程式为____________________。
(3)要从锥形瓶内所得的混合物中提取甲酸甲酯,可采用的方法为____________________。
Ⅱ.甲酸能脱水制取一氧化碳,一定条件下,![]() 能与
能与![]() 固体发生反应:
固体发生反应:![]() 。
。
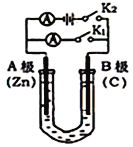
(1)如图所示是以甲酸钠![]() 溶液为电解质溶液的甲醇燃料电池:
溶液为电解质溶液的甲醇燃料电池:

则a极电极反应式为_______________。
(2)测定产物中甲酸钠![]() 的纯度:
的纯度:![]() 与足量
与足量![]() 充分反应后,消耗标况下
充分反应后,消耗标况下![]() ,所得固体物质为
,所得固体物质为![]() ,则所得固体物质中甲酸钠的质量分数为_______(计算结果精确到0.1%)。
,则所得固体物质中甲酸钠的质量分数为_______(计算结果精确到0.1%)。
(3)甲酸钠溶液呈弱碱性的原因:__________________(用离子方程式表示)
【答案】直形冷凝管 平衡内外气压 冷凝回流产品 HCOOH+CH3OH![]() HCOOCH3+H2O 蒸馏 CH3OH-6e-+8OH-=CO32-+6H2O;
HCOOCH3+H2O 蒸馏 CH3OH-6e-+8OH-=CO32-+6H2O; ![]() HCOO-+H2O
HCOO-+H2O![]() HCOOH+OH-
HCOOH+OH-
【解析】
Ⅰ.(1)由仪器结构,可知仪器A为直形冷凝管;由蒸气冷凝为液体,装置内压强会减小,长玻璃管c可以平衡压强,也可以将产品蒸气进行冷凝回流;
(2)甲酸与甲醇在浓硫酸、加热条件下发生酯化反应生成甲酸甲酯与水;
(3)锥形瓶内为液态混合物,用蒸馏方法提取甲酸甲酯;
Ⅱ.(1) 甲醇燃料电池中甲醇作负极,氧气作正极;
(2) 标准状况下![]() 的物质的量为0.1mol,根据
的物质的量为0.1mol,根据![]() ,甲酸钠的物质的量为0.1mol,据此计算甲酸钠的理论质量,再求纯度;
,甲酸钠的物质的量为0.1mol,据此计算甲酸钠的理论质量,再求纯度;
(3) 甲酸钠溶液呈弱碱性的原因是甲酸根离子水解;
Ⅰ.(1)由仪器结构,可知仪器A为直形冷凝管;由蒸气冷凝为液体,装置内压强会减小,长玻璃管c可以平衡压强,也可以将产品蒸气进行冷凝回流,故答案为:直形冷凝管;平衡内外气压;冷凝回流产品;
(2)甲酸与甲醇在浓硫酸、加热条件下发生酯化反应生成甲酸甲酯与水,化学反应方程式为:HCOOH+CH3OH![]() HCOOCH3+H2O,故答案为:HCOOH+CH3OH
HCOOCH3+H2O,故答案为:HCOOH+CH3OH![]() HCOOCH3+H2O;
HCOOCH3+H2O;
(3)锥形瓶内为液态混合物,且甲酸、甲醇、甲酸甲酯的沸点相差很大,所以可以用蒸馏的方法提取甲酸甲酯,故答案为:蒸馏;
Ⅱ.(1) 甲酸钠为电解质溶液,电解质溶液显碱性,甲醇燃料电池中甲醇作负极,则a极室为负极,其电极反应式为:CH3OH-6e-+8OH-=CO32-+6H2O,故答案为:CH3OH-6e-+8OH-=CO32-+6H2O;
(2) 标准状况下![]() 的物质的量为0.1mol,根据
的物质的量为0.1mol,根据![]() ,甲酸钠的物质的量为0.1mol,则甲酸钠的质量为:m=n·M=0.1mol×68g/mol=6.8g,所得固体物质为
,甲酸钠的物质的量为0.1mol,则甲酸钠的质量为:m=n·M=0.1mol×68g/mol=6.8g,所得固体物质为![]() ,则所得固体物质中甲酸钠的质量分数为:
,则所得固体物质中甲酸钠的质量分数为:![]() ,故答案为:
,故答案为:![]()
(3) 甲酸钠是强碱弱酸盐,甲酸根离子水解生成甲酸和氢氧根离子,使溶液呈弱碱性,其水解方程式为:HCOO-+H2O![]() HCOOH+OH-,故答案为:HCOO-+H2O
HCOOH+OH-,故答案为:HCOO-+H2O![]() HCOOH+OH-。
HCOOH+OH-。

【题目】现有某些短周期元素的性质或原子结构信息如表所示。
元素 | 元素性质或原子结构信息 |
T | M层上有6个电子 |
X | 最外层电子数是次外层电子数的2倍 |
Y | 常温下的单质为双原子分子,其简单氢化物的水溶液呈碱性 |
Z | 元素的最高正价是+7 |
(1)元素X的一种同位素可测定文物年代,这种同位素的符号是______。
(2)元素Y与氢元素能形成两种常见的10电子微粒,且在一定条件下,其中一种微粒与OH反应可以转化为另一种微粒,该反应的离子方程式为_________________。
(3)元素Z与元素T相比,非金属性较强的是______(填元素符号),下列表述能证明这一事实的是_______(填序号)。
a.常温下Z的单质和T的单质状态不同
b.Z的简单氢化物比T的简单氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)T、X、Y、Z四种元素的最高价氧化物对应的水化物中化学性质明显不同于其他三种的是____(填对应酸的化学式),理由是__________。
【题目】下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
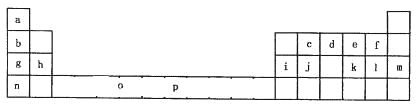
试回答下列问题:
(1)元素p为26号元素,请画出其基态原子外围电子排布图______________;
(2)e与a反应的产物的分子中中心原子的杂化形式为________________;该分子是_________(填“极性”或“非极性”)分子。
(3)上表中元素基态原子的第一电离最大的元素是__________。(用元素符号表示)
(4)o、p两元素的部分电离能数据列于下表:
元 素 | O | P | |
电离能 | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
比较两元素的I2、I3可知,气态o2+再失去一个电子比气态p2+再失去一个电子难,对此,你的解释是______________;