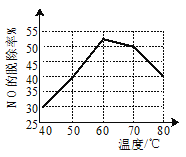
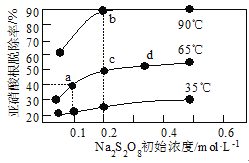
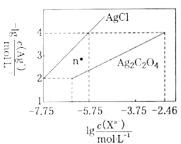
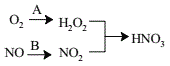题目内容
【题目】实验室用如图所示裝置制备氯气并进行性质实验(必要时可加热,省略夹持装置)
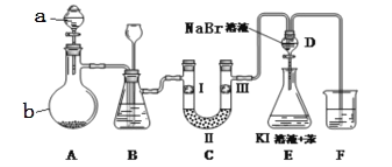
(1)仪器a的名称是:_______;装置B中长颈漏斗的作用是:_______。蒸馏烧瓶b中发生反应的化学方程式为________。
(2)洗气装置B试剂是饱和食盐水,其作用是______,分液漏斗D中发生反应的化学方程式为________。
(3)F处为尾气吸收装置,写出实验室利用烧碱溶液吸收Cl2的离子方程式_______。
(4)设计实验比较氯、溴的氧化性强弱。操作和现象和结论为:取适量溴化钠溶液和苯混合于试管中,通入_______,振荡静置,_______。
【答案】分液漏斗 平衡装置中压强,防止爆炸 MnO2+4HC1(浓)![]() MnCl2+Cl2↑+2H2O 除去氯气中的氯化氢气体 Cl2+2NaBr=Br2+2NaC1 Cl2+2OH-=Cl-+ClO-+H2O 氯气 溶液分层,上层溶液显棕红色,说明氯气的氧化性比溴强
MnCl2+Cl2↑+2H2O 除去氯气中的氯化氢气体 Cl2+2NaBr=Br2+2NaC1 Cl2+2OH-=Cl-+ClO-+H2O 氯气 溶液分层,上层溶液显棕红色,说明氯气的氧化性比溴强
【解析】
装置A是MnO2和浓盐酸在加热条件下反应生成氯气,氯气中含杂质氯化氢,通过装置B中饱和食盐水除去,通过无水氯化钙干燥气体,验证氯气是否具有漂白性,则先通过I中湿润的有色布条,观察到褪色,再利用II中固体干燥剂(无水氯化钙或硅胶)干燥后,在Ⅲ中放入干燥的有色布条,观察到颜色不褪,则验证氯气不具有漂白性,D、E的目的是比较氯、溴、碘的氧化性,D中发生氯气与NaBr的反应生成溴,打开活塞,将装置D中少量溶液加入装置E中,氯气、溴均可与KI反应生成碘,则E中碘易溶于苯,出现分层后上层为紫红色的苯层,该现象不能说明溴的氧化性强于碘,过量的氯气也可将碘离子氧化,应排除氯气的干扰,最后剩余气体被氢氧化钠吸收。
(1)根据装置图可知装置A中仪器a名称为分液漏斗,装置B中NaCl溶液可以除去Cl2中混有的HCl杂质气体,其中的长颈漏斗可以平衡气压,防止发生爆炸,因此装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,若C发生堵塞时B中的压强增大,B中长颈漏斗中液面上升,形成水柱,装置B中长颈漏斗的作用是平衡装置中压强,防止玻璃仪器破裂,蒸馏烧瓶b中发生反应是二氧化锰和浓盐酸加热反应生成氯化锰、氯气和水,反应的化学方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(2)浓盐酸易挥发,制备的氯气中含有氯化氢,氯化氢易溶于水,氯气在饱和食盐水中溶解度很小,所以洗气装置B中饱和食盐水作用是除去Cl2中的HCl;在分液漏斗D中Cl2与NaBr发生置换反应,产生Br2,发生反应的化学方程式为:Cl2+2NaBr=Br2+2NaCl;
(3)F处为尾气吸收装置,装置F中盛有NaOH溶液,可以除去未反应的Cl2、及挥发的Br2蒸气,氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,离子方程式:Cl2+2OH-=Cl-+ClO-+H2O;
(4)由于氧化性Cl2>Br2,所以要设计实验比较氯、溴的氧化性强弱,可以取适量溴化钠溶液和苯混合于试管中,通入的氯气,振荡、静置,由于Br2易溶于苯,苯与水互不相溶,且苯的密度比水小,若观察到:上层的苯层呈棕红色,说明氯气的氧化性比溴强。

 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案【题目】现有某些短周期元素的性质或原子结构信息如表所示。
元素 | 元素性质或原子结构信息 |
T | M层上有6个电子 |
X | 最外层电子数是次外层电子数的2倍 |
Y | 常温下的单质为双原子分子,其简单氢化物的水溶液呈碱性 |
Z | 元素的最高正价是+7 |
(1)元素X的一种同位素可测定文物年代,这种同位素的符号是______。
(2)元素Y与氢元素能形成两种常见的10电子微粒,且在一定条件下,其中一种微粒与OH反应可以转化为另一种微粒,该反应的离子方程式为_________________。
(3)元素Z与元素T相比,非金属性较强的是______(填元素符号),下列表述能证明这一事实的是_______(填序号)。
a.常温下Z的单质和T的单质状态不同
b.Z的简单氢化物比T的简单氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)T、X、Y、Z四种元素的最高价氧化物对应的水化物中化学性质明显不同于其他三种的是____(填对应酸的化学式),理由是__________。