题目内容
【题目】有一固体混合物,可能由Na2CO3、Na2SO4、CuSO4、CaCl2、NaCl等混合而成,为检验它们,做了以下实验:
①将固体混合物溶于水中,搅拌后得无色透明溶液;
②往此溶液中滴加硝酸钡溶液,有白色沉淀产生;
③过滤,将沉淀物置于稀硝酸中,发现沉淀全部溶解。
根据上述实验事实,回答下列问题:
(1)原固体混合物中一定含有的物质是________,一定不含有的物质是________,可能含有的物质是________(以上空格均填写化学式)。对可能含有的物质,可采用向滤液中滴加___________________溶液的方法来检验。
(2)写出步骤③中的离子方程式__________________________________________________。
【答案】 Na2CO3 Na2SO4、CuSO4、CaCl2 NaCl 硝酸酸化的硝酸银 BaCO3+2H+![]() Ba2++CO2↑+H2O
Ba2++CO2↑+H2O
【解析】
试题(1)①溶于水后,得到无色溶液,说明不含CuSO4,因为Cu2+显蓝色,②加入硝酸钡溶液,有白色沉淀,可能是BaSO4,也可能是BaCO3,也可能是它们的混合物,③加入硝酸,沉淀全部溶解,说明沉淀是BaCO3,混合物中含有Na2CO3,一定不含Na2SO4,因为BaSO4不溶于硝酸,总上所述混合物中一定含有混合物是Na2CO3,一定不含有的物质是Na2SO4、CuSO4,可能含有的物质是NaCl,AgCl不溶于硝酸,可以采用加入硝酸,然后再加硝酸银溶液,如果有沉淀产生,说明含有NaCl;(2)反应化学方程式为BaCO3+2HNO3=Ba(NO3)2+H2O+CO2↑,难溶物、水、气体不能拆,因此离子反应方程式为:BaCO3+2H+=Ba2++H2O+CO2↑。

 名校课堂系列答案
名校课堂系列答案【题目】一种从含Br-废水中提取Br2的过程,包括过滤、氧化、正十二烷萃取及蒸馏等步骤。已知:
Br2 | CCl4 | 正十二烷 | |
密度/g·cm-3 | 3.119 | 1.595 | 0.753 |
沸点/℃ | 58.76 | 76.8 | 215~217 |
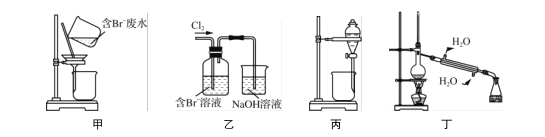
下列说法正确的是( )
A. 用甲装置过滤时,需不断搅拌
B. 用乙装置将Br-氧化为Br2
C. 丙装置中用正十二烷而不用CCl4,是因为其密度小
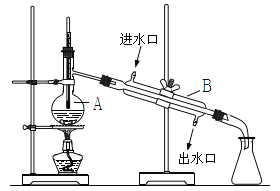
D. 可用装置丁进行蒸馏,先收集正十二烷再收集Br2