ЬтФПФкШн
ЁОЬтФПЁП25 ЁцЪБЃЌНЋ0.10 molЁЄLЃ1 CH3COOHШмвКЕЮМгЕН10 mL 0.10 molЁЄLЃ1 NaOHШмвКжаЃЌlg![]() гыpHЕФЙиЯЕШчЭМЫљЪОЃЌCЕузјБъЪЧ(6ЃЌ1.7)ЁЃЯТСаЫЕЗЈВЛе§ШЗЕФЪЧ(ЁЁЁЁ)
гыpHЕФЙиЯЕШчЭМЫљЪОЃЌCЕузјБъЪЧ(6ЃЌ1.7)ЁЃЯТСаЫЕЗЈВЛе§ШЗЕФЪЧ(ЁЁЁЁ)

A. pHЃН7ЪБМгШыЕФДзЫсШмвКЕФЬхЛ§Дѓгк10 mL
B. CЕуКѓМЬајМгШыДзЫсШмвКЃЌЫЎЕФЕчРыГЬЖШМѕаЁ
C. BЕуДцдкc(NaЃЋ)Ѓc(CH3COOЃ)ЃН(10Ѓ6Ѓ10Ѓ8)molЁЄLЃ1
D. Ka(CH3COOH)ЃН5.0ЁС10Ѓ5
ЁОД№АИЁПC
ЁОНтЮіЁП
AЁЂНЋДзЫсЕФЕчРыГЃЪ§Ka=![]() ШЁЖдЪ§ЃЌПЩЕУЕНlg
ШЁЖдЪ§ЃЌПЩЕУЕНlg![]() =lg Ka+pHЁЃ ЕБЭљ10 mL 0.10 mol./L NaOHШмвКжаМгШы10 mL 0. 10mol./LДзЫсШмвКЪБЃЌЕУЕНCH3COONaШмвКЃЌШмвКГЪМюадЁЃЙЪЕБpH=7ЪБМгШыЕФДзЫсШмвКЬхЛ§гІДѓгк10mLЃЌбЁЯюAе§ШЗЃЛ
=lg Ka+pHЁЃ ЕБЭљ10 mL 0.10 mol./L NaOHШмвКжаМгШы10 mL 0. 10mol./LДзЫсШмвКЪБЃЌЕУЕНCH3COONaШмвКЃЌШмвКГЪМюадЁЃЙЪЕБpH=7ЪБМгШыЕФДзЫсШмвКЬхЛ§гІДѓгк10mLЃЌбЁЯюAе§ШЗЃЛ
BЁЂCЕуpH=6ЃЌCЕуКѓМЬајМгШыДзЫсШмвКЃЌШмвКpHМѕаЁЃЌЫЕУїCH3COOHЕФХЈЖШдіДѓЃЌЖдЫЎЕФЕчРыЕФвжжЦГЬЖШдіДѓЃЌЫЎЕФЕчРыГЬЖШМѕаЁЃЌбЁЯюBе§ШЗЃЛ
CЁЂгЩЭМжааХЯЂПЩжЊЃЌBЕузјБъЮЊЃЈ8.3ЃЌ4ЃЉЃЌНЋlg![]() =4ДњШыlg Ka(CH3COOH)=lg
=4ДњШыlg Ka(CH3COOH)=lg![]() -pH =4-8.3= - 4.3ЕУЁЃpH=8.3ЃЌдђc(H+)=10-8.3mol/LЃЌНсКЯЕчКЩЪиКуПЩЕУc(CH3COO-)+c(OH-)=c(H+)+c(Na+)ЃЌЙЪc(Na+)-c(CH3COO-)=c(OH-)-c(H+)=(10-5.7-10-8.3)mol/LЃЌбЁЯюCДэЮѓЃЛ
-pH =4-8.3= - 4.3ЕУЁЃpH=8.3ЃЌдђc(H+)=10-8.3mol/LЃЌНсКЯЕчКЩЪиКуПЩЕУc(CH3COO-)+c(OH-)=c(H+)+c(Na+)ЃЌЙЪc(Na+)-c(CH3COO-)=c(OH-)-c(H+)=(10-5.7-10-8.3)mol/LЃЌбЁЯюCДэЮѓЃЛ
DЁЂKa(CH3COOH)=![]() ЃЌlg Ka(CH3COOH)=lg
ЃЌlg Ka(CH3COOH)=lg![]() -pHЃЌНЋCЕузјБъ(6ЃЌ1.7)ДњШыПЩЕУЃЌlg Ka(CH3COOH)=1.7-6=-4.3ЃЌKa(CH3COOH)=5.0ЁС10-5ЃЌбЁЯюDе§ШЗЃЛ
-pHЃЌНЋCЕузјБъ(6ЃЌ1.7)ДњШыПЩЕУЃЌlg Ka(CH3COOH)=1.7-6=-4.3ЃЌKa(CH3COOH)=5.0ЁС10-5ЃЌбЁЯюDе§ШЗЃЛ
Д№АИбЁCЁЃ

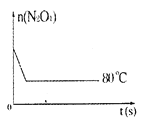
ЁОЬтФПЁПдк80ЁцЪБЃЌ0.40molЕФN2O4ЦјЬхГфШы2LвбОГщПеЕФЙЬЖЈШнЛ§ЕФУмБеШнЦїжаЗЂЩњШчЯТЗДгІЃКN2O4![]() 2NO2ЃQЃЌИєвЛЖЮЪБМфЖдИУШнЦїФкЕФЮяжЪНјааЗжЮіЃЌЕУЕНШчЯТЪ§ОнЃК
2NO2ЃQЃЌИєвЛЖЮЪБМфЖдИУШнЦїФкЕФЮяжЪНјааЗжЮіЃЌЕУЕНШчЯТЪ§ОнЃК
ЪБМфЃЈsЃЉnЃЈmolЃЉ | 0 | 20 | 40 | 60 | 80 | 100 |
nЃЈN2O4ЃЉ | 0.40 | a | 0.20 | c | d | e |
nЃЈNO2ЃЉ | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
ЃЈ1ЃЉМЦЫу20sЁЊ40sФкгУN2O4БэЪОЕФЦНОљЗДгІЫйТЪЮЊ____ЁЃ
ЃЈ2ЃЉИУЗДгІЕФЦНКтГЃЪ§K=___ЁЃ
ЃЈ3ЃЉЗДгІНјаажС100sКѓНЋЗДгІЛьКЯЮяЕФЮТЖШНЕЕЭЃЌЛьКЯЦјЬхЕФбеЩЋ___ЃЈЬюЁАБфЧГЁБЁЂЁАБфЩюЁБЛђЁАВЛБфЁБЃЉЁЃ
ЃЈ4ЃЉвЊдіДѓИУЗДгІЕФKжЕЃЌПЩВЩШЁЕФДыЪЉгаЃЈЬюађКХЃЉ___ЃЌШєвЊжиаТДяЕНЦНКтЪБЃЌЪЙ[NO2]/[N2O4]жЕБфаЁЃЌПЩВЩШЁЕФДыЪЉгаЃЈЬюађКХЃЉ___ЁЃ
AЃЎдіДѓN2O4ЕФЦ№ЪМХЈЖШ BЃЎЯђЛьКЯЦјЬхжаЭЈШыNO2
CЃЎЪЙгУИпаЇДпЛЏМС DЃЎЩ§ИпЮТЖШ
ЃЈ5ЃЉШчЭМЪЧ80ЁцЪБШнЦїжаN2O4ЮяжЪЕФСПЕФБфЛЏЧњЯпЃЌЧыдкИУЭМжаВЙЛГіИУЗДгІдк60ЁцЪБN2O4ЮяжЪЕФСПЕФБфЛЏЧњЯпЁЃ____