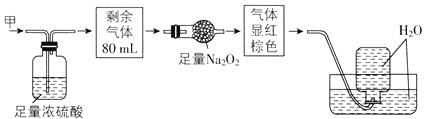
题目内容
【题目】25℃,将浓度均为0.1mol/L的HA溶液Va mL和BOH溶液Vb mL混合,保持Va+Vb=100mL,生成物BA易溶于水。Va、Vb与混合液pH的关系如下图。下列叙述错误的是

A.HA一定是弱酸
B.BOH可能是强碱
C.z点时,水的电离被促进
D.x、y、z点时,溶液中都存在c(A-)+c(OH-)=c(B+)+c(H+)
【答案】C
【解析】
A. 当Va=Vb=50mL时,溶液相当于BA溶液,此时溶液的pH>7呈碱性,说明BA是强碱弱酸盐,这里的强弱是相对的,则HA一定是弱酸,故A正确;
B. 当Va=Vb=50mL时,溶液相当于BA溶液,此时溶液的pH>7呈碱性,说明BA是强碱弱酸盐,这里的强弱是相对的,BOH可能是强碱也可能是电离程度比HA大的弱碱,故B正确;
C. z点时,BOH溶液的体积Vb mL大于HA溶液的体积Va mL,混合溶液的pH大于9,即c(H+)<10-9,25℃时该溶液中水的电离被抑制,故C错误;
D. x、y、z点时,溶液中都存在电荷守恒:c(A-)+c(OH-)=c(B+)+c(H+),故D正确;
题目要求选择错误的,故选C。

练习册系列答案
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案
相关题目