题目内容
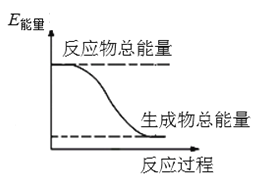
【题目】2016年9月我国成功利用大功率运载火箭发射“天宫二号”空间实验室。火箭推进器中装有还原剂肼(N2H4)(液态)和强氧化剂过氧化氢(H2O2),如图是一定量肼完全反应生成氮气和水过程中的能量变化图。请回答下列问题:
(1)肼又名联氨,请推测它的结构式:__________________________。
(2)液态肼与过氧化氢的反应属于________(填“吸热”或“放热”)反应。
(3)写出该火箭推进器中相关反应的化学方程式:_____________________。
(4)已知肼和氧气可发生如下反应:N2H4(g)+O2(g)N2(g)+2H2O(g)
①某温度下,容积固定的密闭容器中,下列描述可说明上述反应达到平衡的是______。
A. υ(N2) = υ(N2H4)
B. c(N2H4) : c(O2) : c(N2) = 1:1:1
C. 混合气体的密度不再发生变化
D. 体系的压强不再发生变化
E. 混合气体的平均相对分子质量不再发生变化
F. 每断开1 mol O=O键,同时断开4 mol H-O键
②若想要增加该反应的正反应速率,你认为一定可行的方法有:____________。
A. 升高反应温度 B. 加入适当的催化剂
C. 向容器中加入氧气 D. 向容器中加入氖气
【答案】 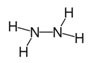 放热 N2H4 + 2H2O2 = N2 + 4H2O DEF ABC
放热 N2H4 + 2H2O2 = N2 + 4H2O DEF ABC
【解析】(1)肼的化学式为N2H4,N原子最外层有5个电子,形成三对共用电子对达到8电子的稳定结构。
(2)反应物总能量大于生成物总能量,肼与过氧化氢的反应属于放热反应。
(3)肼与过氧化氢反应生成N2和H2O,根据得失电子守恒和原子守恒配平。
(4)①根据反应达到平衡的本质标志和特征标志作答。
②根据外界条件对化学反应速率的影响作答。
(1)肼的化学式为N2H4,N原子最外层有5个电子,形成三对共用电子对达到8电子的稳定结构,肼的电子式为![]() ,结构式为
,结构式为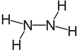 。
。
(2)反应物总能量大于生成物总能量,肼与过氧化氢的反应属于放热反应。
(3)肼与过氧化氢反应生成N2和H2O,根据得失电子守恒和原子守恒,火箭推进器中发生的反应为N2H4+2H2O2=N2+4H2O。
(4)①A项,υ(N2)=υ(N2H4)未指明是正反应速率还是逆反应速率,不能说明反应达到平衡状态;B项,c(N2H4):c(O2):c(N2)=1:1:1,不代表各组分的浓度保持不变,不能说明反应达到平衡状态;C项,根据质量守恒定律,混合气体的总质量始终不变,密闭容器的容积固定,混合气体的密度始终不变,混合气体的密度不再变化不能说明反应达到平衡状态;D项,该反应的正反应为气体分子数增大的反应,建立平衡的过程中气体分子物质的量增大,在恒温恒容时,体系的压强增大,达到平衡时气体分子物质的量不变,体系的压强不变,体系的压强不再变化能说明反应达到平衡状态;E项,根据质量守恒定律,混合气体的总质量始终不变,该反应的正反应为气体分子数增大的反应,建立平衡的过程中气体分子物质的量增大,混合气体的平均相对分子质量减小,达到平衡时混合气体分子物质的量不变,混合气体的平均相对分子质量不变,混合气体的平均相对分子质量不再发生变化能说明反应达到平衡状态;F项,每断开1molO=O键同时生成4molH-O键,生成4molH-O键同时断开4molH-O键,说明反应达到平衡状态;可说明反应达到平衡状态的是DEF,答案选DEF。
②A项,升高反应温度,该反应的正反应速率增加;B项,加入适当的催化剂,降低反应的活化能,该反应的正反应速率增加;C项,向容器中加入O2,增大反应物浓度,正反应速率增加;D项,向恒容容器中加入氖气,各组分浓度不变,化学反应速率不变;增加正反应速率的方法有:ABC,答案选ABC。

 初中暑期衔接系列答案
初中暑期衔接系列答案【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是

选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
【题目】碳、及其化合物在生产中有重要应用。
(1)设反应 ① Fe(s) + CO2(g)![]() FeO(s) + CO(g) ⊿H = Q1 平衡常数为K1
FeO(s) + CO(g) ⊿H = Q1 平衡常数为K1
② Fe(s) + H2O(g)![]() FeO(s) + H2(g) ⊿H = Q2 平衡常数为K2
FeO(s) + H2(g) ⊿H = Q2 平衡常数为K2
不同温度下,K1、K2的值如下表
T/K | K1 | K2 |
973 | 1.47 | 2.38 |
1173 | 2.15 | 1.67 |
现有反应 ③ H2(g) + CO2(g)![]() CO(g) + H2O(g) ⊿H = Q3,结合上表数据,根据反应①、②推导出Q1、Q2、Q3的关系式Q3=_____________,反应③是________(填“放”或“吸”)热反应。
CO(g) + H2O(g) ⊿H = Q3,结合上表数据,根据反应①、②推导出Q1、Q2、Q3的关系式Q3=_____________,反应③是________(填“放”或“吸”)热反应。
(2)已知CO2催化加氢合成乙醇的反应原理为:2CO2(g)+6H2(g)![]() C2H5OH(g)+3H2O(g) ⊿H <0
C2H5OH(g)+3H2O(g) ⊿H <0

①图l、图2分别是CO2的平衡转化率随压强及温度的变化关系,已知m为起始时的投料比,即m=n(H2)/n(CO2),图l中投料比相同,温度从高到低的顺序为________,图2中m1、m2、m3从大到小的顺序为_____________。
②图3表示在总压为5MPa的恒压条件下,且m=3时,平衡状态时各物质的物质的量分数与温度的关系。则曲线d代表的物质为________(填化学式),T4温度时,该反应的平衡常数Kp=________。(提示:用平衡分压代替平衡浓度来计算,某组分平衡分压=总压×该组分的物质的量分数,结果保留小数点后三位)
【题目】卤族元素的单质能与H2反应
H2+F2=2HF | 在暗处能剧烈化合并发生爆炸 |
H2+Cl2=2HCl | 光照或点燃发生反应 |
H2+Br2=2HBr | 加热至一定温度才能反应 |
H2+I2=2HI | 不断加热才能缓慢反应,生成的HI会分解 |
(1)用电子式表示HCl的形成过程_____________________________。
(2)依据上表,可以推测出:随着原子序数的递增,________(填字母)。
a. 单质的熔沸点逐渐升高 b. 元素的非金属性逐渐减弱
c. 卤化氢的还原性依次减弱 d. 卤化氢的稳定性依次减弱
(3)不同卤素原子之间可形成卤素互化物,其性质与卤素单质相近。写出BrCl和SO2在水溶液中发生反应的化学方程式___________________________________。
【题目】活性氧化锌(ZnO)粒径介于1-100 nm之间,是一种面向21世纪的新型高功能精细无机产品,表现出许多特殊的性质。某研究所以粗氧化锌(含少量CuO、FeO、MnO、Fe2O3等)为原料,采用湿化学法(NPP-法)制备纳米级活性氧化锌,生产工艺流程如图:
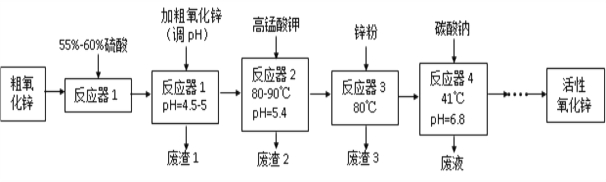
已知:
①pH=5.4时,KMnO4的还原产物为MnO2。
②以上实验条件下各种氢氧化物沉淀的pH情况如下表所示。
Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | Zn(OH)2 | Mn(OH)2 | |
开始沉淀的pH | 7.5 | 2.2 | 5.2 | 6.4 | 8.6 |
沉淀完全的pH | 9.0 | 3.2 | 6.7 | 8.0 | 10.1 |
根据以上信息,回答下列问题:
(1)工艺过程中各步骤均用到的分离方法是_______________________________。
(2)“废渣1”的主要成分是______________________________________________。
(3)“反应器2”中两个氧化还原反应的离子方程式为_______________________________________________________________
(4) “反应器3”中加入锌粉的作用是________________________________。
(5)“反应器4”得到的废液中,含有的主要离子除了Na+外,还有______________。