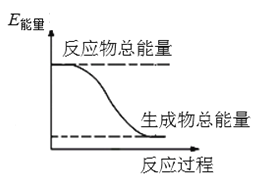
题目内容
【题目】下图为生锈了的家用铁锅,下列有关解释事实的方程式不正确的是

A. 铁锅生锈过程中有原电池反应,负极反应式是:Fe—2e—= Fe2+
B. 铁锅生锈过程中有 Fe(OH)3生成:Fe3+ + 3H2O![]() Fe(OH)3 + 3H+
Fe(OH)3 + 3H+
C. 摄入体内的铁锈会在胃内产生不利于健康的Fe3+:Fe2O3 + 6H+=2Fe3++3H2O
D. 用醋可除去铁锈:6CH3COOH + Fe2O3 =6CH3COO—+ 2Fe3+ + 3H2O
【答案】B
【解析】A、铁锅生锈过程属于原电池,属于吸氧腐蚀,负极反应式为Fe-2e-=Fe2+,故A说法正确;B、铁锅生锈的过程是:负极反应式为Fe-2e-=Fe2+,正极反应式为O2+2H2O+4e-=4OH-,即电池总反应式为2Fe+O2+2H2O=2Fe(OH)2,Fe(OH)2被空气中氧气氧化成Fe(OH)3:4Fe(OH)2+O2+2H2O=4Fe(OH)3,故B说法错误;C、胃酸的成分是盐酸,铁锈是Fe2O3,属于碱性氧化物,发生Fe2O3+6H+=2Fe3++3H2O,故C说法正确;D、醋中含有醋酸,与Fe2O3发生:6CH3COOH + Fe2O3 =6CH3COO-+ 2Fe3+ + 3H2O,故D说法正确。

练习册系列答案
相关题目