题目内容
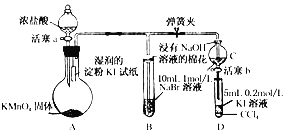
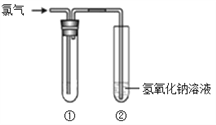
【题目】某研究小组的同学用下图所示装置进行氯气的性质实验。
请回答:
(1)若要得到干燥的氯气,则①中所加的试剂应为_____。
(2)若①中盛放的是湿润的红纸条,则观察到的现象为_____。
(3)若①要验证氯气具有氧化性,则所用的溶液不能是_____(填序号)。
a. FeCl2 b. 溴水 c. KI溶液
(4)装置②中反应的离子方程式是_____。
【答案】 浓硫酸 湿润的红纸条褪色 b Cl2 + 2OH- = Cl- + ClO- + H2O
【解析】结合所给装置,干燥氯气需用浓硫酸;氯水具有漂白性,能使湿润的红纸条褪色;氯气具有氧化性,可以通过和还原性物质反应产生现象来要验证氯气具有氧化性;装置②中发生的是氯气和氢氧化钠的反应,以此分析。
结合以上分析(1)若要得到干燥的氯气,则①中所加的试剂应为浓硫酸。
(2)若①中盛放的是湿润的红纸条,因为氯水具有漂白性,所以可观察到的现象为湿润的红纸条褪色。
(3)a. 将氯气通入FeCl2溶液,FeCl2被氯气氧化,溶液由浅绿色变为棕黄色,可以证明氯气具有氧化性,a正确;b.将氯气通入溴水不反应,故b错误;c. 将氯气通入KI溶液溶液,KI溶液被氯气氧化生成I2,溶液由无色变为黄色,可以证明氯气具有氧化性,c正确;因此本题答案选b。
(4)装置②中用氢氧化钠溶液吸收多余氯气,反应的离子方程式是Cl2 + 2OH- =Cl- + ClO- + H2O。因此本题答案为:Cl2 + 2OH- = Cl- + ClO- + H2O。

【题目】木炭、活性炭、炭黑、焦炭是由石墨的微小晶体和少量杂质构成的,均属混合物。没有固定的几何外形,所以称为无定形碳,在工业上有着重要用途。回答下列问题:
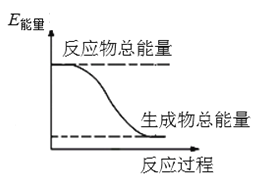
(1)木炭与硫黄、火硝(硝酸钾)按一定比例混合即为黑火药。黑火药爆炸时生成硫化钾、氮气和二氧化碳。黑火药爆炸的化学方程式为____________。若有15g木炭参加反应,转移电子数为____________。
(2)工业上的炭黑是由烃类裂解而制得的高度分散性的黑色粉末状物质。
①已知几个反应的热化学方程式:
C(s)+O2 (g)CO2(g) ΔH1=393.5 kJmol1
2H2(g)+O2 (g)2H2O(1) ΔH2=571.6 kJmol1
CH4(g)+2O2(g)CO2(g)+ 2H2O(1) ΔH3=890.3 kJmol1
则由天然气生产炭黑的热化学方程式为____________。
②右图是温度对天然气生产炭黑转化率的影响,下列有关说法正确的是____________。
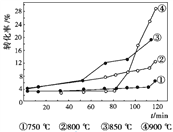
A. 甲烷裂解属于吸热反应
B. 增大体系压强,能提高甲烷的转化率
C. 在反应体系中加催化剂,反应速率增大
D. 升高温度,该反应的平衡常数减小
(3)活性炭可以用来净化气体和液体。
①用活性炭还原氮氧化物,可防止空气污染。向1 L密闭容器加入一定量的活性炭和NO,某温度下发生反应C(s)+ 2NO(g)![]() N2(g)+CO2(g),测得不同时间内各物质的物质的量如下表:
N2(g)+CO2(g),测得不同时间内各物质的物质的量如下表:
物质的量/mol 时间/min | NO | N2 | CO2 |
0 | 0.200 | 0 | 0 |
10 | 0.116 | 0.042 | 0.042 |
20 | 0.080 | 0.060 | 0.060 |
30 | 0.080 | 0.060 | 0.060 |
此温度下,该反应的平衡常数K=____________ (保留两位小数)。10~20min内,NO的平均反应速率为____________;若30 min后升高温度,达到新平衡时,容器中c(NO)∶c(N2)∶c(CO2)=2∶1∶1,则该反应的ΔH____________0(填“>”、“<”或“=”)。
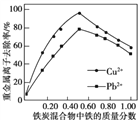
②活性炭和铁屑混合可用于处理水中污染物。在相同条件下,测量总质量相同、铁的质量分数不同的铁炭混合物对水中span>Cu2+和Pb2+的去除率,结果如图所示。当混合物中铁的质量分数为0时,也能去除水中少量的Cu2+和Pb2+,其原因是____________;当混合物中铁的质量分数大于50%时,随着铁的质量分数的增加,Cu2+和Pb2+的去除率不升反降,其主要原因是____________。