题目内容
【题目】某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
①固定好滴定管F并使滴定管尖嘴充满液体;
②用蒸馏水洗涤碱式滴定管F,并立即注入NaOH溶液至“0”刻度线以上;
③用标准液滴定至终点,记下滴定管液面读数;
④移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;
⑤调节液面至“0”或“0”刻度线稍下,并记下读数。
请回答:
(1)以上步骤合理的顺序为(填编号)____________________,
(2)排去碱式滴定管中气泡的方法应采用如图所示操作中的________,然后轻轻挤压玻璃球使尖嘴部分充满碱液。
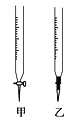

(3)滴定管F中应该选择右图中滴定管_____(填标号)。
(4)错误操作会导致测定结果(填“偏大”、“偏小”或“无影响”)
A.盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗___________;
B.滴定终点读数时,俯视滴定管的刻度,其他操作正确___________;
C.用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液___________;
D.配制标准溶液的NaOH中混有KOH杂质___________;
(5)滴定操作中,左手_____________,右手______________,眼睛应观察(填编号)_________A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
(6)判断滴定终点的现象是:锥形瓶中溶液______________________________;
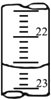
(7)如下图是某次滴定时的滴定管中的液面,其读数为________mL;
(8)根据下列数据:请计算待测盐酸溶液的浓度:______mol/L。
滴定次数 | 待测体积(mL) | 标准烧碱体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 20.00 | 0.40 | 20.40 |
第二次 | 20.00 | 2.00 | 24.10 |
第三次 | 20.00 | 4.00 | 24.00 |
【答案】 ②①⑤④③ 丙 乙 无影响 偏小 偏大 偏大 控制碱式滴定管活塞 摇动锥形瓶 B 由无色变浅红色,且半分钟内不消失 22.60mL 0.2000mol·L-1
【解析】(1)用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作顺序如下:②用蒸馏水洗涤碱式滴定管F,并立即注入NaOH溶液至“0”刻度线以上;①固定好滴定管F并使滴定管尖嘴充满液体;⑤调节液面至“0”或“0”刻度线稍下,并记下读数;④移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;③用标准液滴定至终点,记下滴定管液面读数;答案为②①⑤④③;(2)排去碱式滴定管中气泡的方法应采用如图所示操作中的丙,然后轻轻挤压玻璃球使尖嘴部分充满碱液;(3)滴定管F是碱式滴定管,则应该选择右图中滴定管乙;(4)A.盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗,此操作正确,测定结果无影响;B.滴定终点读数时,俯视滴定管刻度,其他操作正确,导致消耗的标准液体积读数偏小,根据c(待测)= 可知,测定结果偏小;C.用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液,导致标准液浓度偏低,滴定时消耗标准液偏多,根据c(待测)=
可知,测定结果偏小;C.用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液,导致标准液浓度偏低,滴定时消耗标准液偏多,根据c(待测)= 可知,测定结果偏大; D.配制标准溶液的NaOH中混有KOH杂质,所配标准液中氢氧根离子的浓度偏小,滴定时消耗的体积偏大,根据c(待测)=
可知,测定结果偏大; D.配制标准溶液的NaOH中混有KOH杂质,所配标准液中氢氧根离子的浓度偏小,滴定时消耗的体积偏大,根据c(待测)= 可知,测定结果偏大;(5)滴定操作中,左手控制碱式滴定管活塞,右手摇动锥形瓶,眼睛应观察锥形瓶内溶液颜色的变化,答案选B;(6)判断滴定终点的现象是:锥形瓶中溶液由无色变浅红色,且半分钟内不消失;(7)滴定管中的液面读数为22.60mL;(5)三次滴定消耗的体积为:20.00mL, 22.10 mL,20.00mL,舍去第2组数据,然后求出1、3组平均消耗V(NaOH)=20.00mL,c(待测)=
可知,测定结果偏大;(5)滴定操作中,左手控制碱式滴定管活塞,右手摇动锥形瓶,眼睛应观察锥形瓶内溶液颜色的变化,答案选B;(6)判断滴定终点的现象是:锥形瓶中溶液由无色变浅红色,且半分钟内不消失;(7)滴定管中的液面读数为22.60mL;(5)三次滴定消耗的体积为:20.00mL, 22.10 mL,20.00mL,舍去第2组数据,然后求出1、3组平均消耗V(NaOH)=20.00mL,c(待测)= ==0.2000molL-1。
==0.2000molL-1。

 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案【题目】几种短周期元素的原子半径及主要化合价如下表:
元素代号 | X | Y | Z | M | R | Q | U | |
原子半径( | 1.86 | 0.99 | 1.43 | 1.60 | 0.75 | 0.74 | 0.82 | |
主要化合价 | 最高正价 | +1 | +7 | +3 | +2 | +5 | +3 | |
最低负价 | -1 | -3 | -2 | |||||
下列说法错误的是( )
A. 元素X和Q形成的化合物中不可能含有共价键
B. X、Z、R的最高价氧化物的水化物之间可两两相互反应
C. R3-比Q2-更容易失去电子
D. M(OH)2的碱性比XOH的碱性弱