题目内容
(7分)金属及其化合物在生产、生活中有广泛应用。
(1)从结构角度分析Fe3+较Fe2+稳定的原因。
(2)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁晶体属于 晶体。
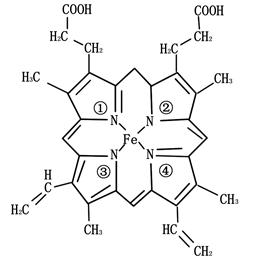
(3)铁元素为血红蛋白和肌红蛋白的活性部分———血红素的重要组成元素,血红素的结构简式如下图所示。与铁原子形成配位键的是 号氮原子(填写氮原子标号)。
(4)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,更适合作录音带磁粉原料的是(填化学式)。
(1)从结构角度分析Fe3+较Fe2+稳定的原因。
(2)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁晶体属于 晶体。
(3)铁元素为血红蛋白和肌红蛋白的活性部分———血红素的重要组成元素,血红素的结构简式如下图所示。与铁原子形成配位键的是 号氮原子(填写氮原子标号)。

(4)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,更适合作录音带磁粉原料的是(填化学式)。
(1)Fe3+的3d能级为3d5,处于半充满状态,较稳定(2分)(2)分子(1分)
(3)①④(2分,漏选得1分,错选倒扣分,本空不出现负分)(4)CrO2(2分)
(3)①④(2分,漏选得1分,错选倒扣分,本空不出现负分)(4)CrO2(2分)
试题分析:(1)Fe3+较Fe2+稳定,是因Fe3+的3d能级为3d5半充满状态,较稳定。
(2)常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华.易溶于水,也易溶于乙醚、丙酮等有机溶剂.则为分子晶体。
(3)N原子最外层有5个电子,只需要形成3条键即可达到稳定结构,但是图中形成双键的N原子形成了四条键,显然有一条为配位键,可表示为
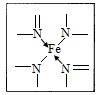 ,故答案为:①④。
,故答案为:①④。(4)V2O5中V的最外层电子全部失去或成键,CrO2中Cr失去4个电子,离子的最外层电子为2,未成对,离子含未成对电子越多,则磁性越大,则适合作录音带磁粉原料的是CrO2。

练习册系列答案
相关题目
 ,违背了 原理。
,违背了 原理。
 ,下列有关说法正确的是________(填选项字母)。
,下列有关说法正确的是________(填选项字母)。
 (n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:
(n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应: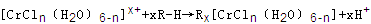
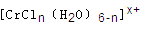 的溶液,与R-H完全交换后,中和生成的需浓度为
的溶液,与R-H完全交换后,中和生成的需浓度为 和黑色的HD两种化合物。
和黑色的HD两种化合物。 中B原子采取的杂化轨道类型为 。
中B原子采取的杂化轨道类型为 。 分子的空间构型为 。
分子的空间构型为 。 极易溶于
极易溶于 ,原因是 。
,原因是 。 表示阿伏伽德罗常数,晶胞的边长为a。晶胞的高为h,则晶胞的密度可表示为 g/cm3。(用只含r和
表示阿伏伽德罗常数,晶胞的边长为a。晶胞的高为h,则晶胞的密度可表示为 g/cm3。(用只含r和
