题目内容
1.如图表示4-溴环己烯所发生的4个不同反应.其中产物含有2种官能团的反应是( )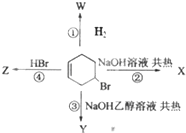
| A. | ① | B. | ①③④ | C. | ② | D. | ①②④ |
分析 由结构可知,有机物中含C=C和-Br,能发生①为加成反应,②为水解反应,③为消去反应,④为加成反应,以此来解答.
解答 解:由结构可知,有机物中含C=C和-Br,
①为加成反应,产物只有-Br一种官能团;
②为水解反应,得到C=C和-OH两种官能团;
③为消去反应,产物中只有C=C;
④为加成反应,产物中只有-Br,
则其中产物含有2种官能团的反应是②,
故选C.
点评 本题考查有机物的官能团及其性质,明确有机物的结构与性质的关系即可解答,注意把烯烃、卤代烃的性质,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
11.在一定温度下,将6mol CO2和8mol H2充入2L恒容密闭容器中,发生如下反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<O
分别在t时测得在该容器内n(H2)的数值如下:
则下列说法正确的是( )
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<O
分别在t时测得在该容器内n(H2)的数值如下:
| t/min | 1 | 4 | 8 | 11 |
| n(H2)/mol | 6 | 2.6 | 2 | 2 |
| A. | 该温度下,平衡常数K=0.5 | |
| B. | 反应进行4min时,V(C02)=0.45 mol/(L•min) | |
| C. | 反应进行到9min时,H2的转化率比8min时高 | |
| D. | 反应进行11min后,若增大容器内压强,CO2的转化率一定增大 |
12.下列有关物质的表达式不正确的是( )
| A. | 醛基的结构简式:-CHO | B. | 溴乙烷的电子式: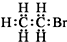 | ||
| C. | 乙炔分子的结构式:H-C≡C-H | D. | 乙醇的分子式:C2H6O |
9.下列热化学方程式书写正确的是(△H的绝对值均正确)( )
| A. | C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g);△H=-1367.0 kJ/mol | |
| B. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l);△H=+57.3kJ/mol | |
| C. | S(s)+O2(g)═SO2(g);△H=-296.8kJ/mol | |
| D. | 2NO2═O2+2NO;△H=+116.2kJ/mol |
16.下列数据是有机物的相对分子质量,可能互为同系物的一组是( )
| A. | 16、30、58、72 | B. | 16、28、40、52 | C. | 16、32、48、54 | D. | 16、30、42、56 |
13.下列说法正确的是( )
| A. | 第二周期元素从C到F,非金属性逐渐减弱 | |
| B. | 第三周期元素从Na到Cl,原子半径逐渐增大 | |
| C. | HF、HCl、HBr、HI的热稳定性依次逐渐增强 | |
| D. | LiOH、NaOH、KOH的碱性依次逐渐增强 |
10.用NA表示阿伏加德罗常数的值,下列有关物质结构中的说法正确的是( )
| A. | 78g Na2O2固体中所含阴阳离子个数均为2NA | |
| B. | 1.5g CH3+中含有的电子数为0.9NA | |
| C. | 3.4g氨气中含0.6NA个N-H键 | |
| D. | PCl3和BCl3分子中所有原子的最外层都达到8电子稳定结构 |
10.工业上用铝土矿(主要成分为Al2O3,杂质为Fe2O3和SiO2)为原料冶炼铝的工艺流程之一为:下列叙述不正确的是( )


| A. | 沉淀甲为SiO2 | |
| B. | 生成沉淀乙的反应为:Fe3++3OH-=Fe(OH)3↓ | |
| C. | 溶液乙中含有AlO2- | |
| D. | 反应③为:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- |