题目内容
6.(1)某原子的最外层电子排布式是4s24p4,该元素是硒(填元素名称),在元素周期表中,该元素在元素周期表中的位置是第四周期第ⅥA族;位于元素周期表p区,最高价氧化物的水化物的化学式为H2SeO4.(2)已知下列元素在周期表中的位置,写出它们的元素符号和价电子排布式:
①第4周期ⅣB族Ti、3d24s2;
②第4周期ⅦA族Br、4s24p5.
分析 (1)某原子的最外层电子排布式是4s24p4,则位于第四周期第ⅥA族,为Se元素,最高价为+6价,最后填充p电子;
(2)①第4周期ⅣB族,为Ti元素,原子序数为22;
②第4周期ⅦA族,为Br元素,原子序数为35,周期数等于电子层数,最外层电子数等于族序数.
解答 解:(1)某原子的最外层电子排布式是4s24p4,则位于第四周期第ⅥA族,为Se元素,名称为硒,最高价为+6价,最高价氧化物的水化物的化学式为H2SeO4,最后填充p电子,则为p区元素,故答案为:硒;第四周期第ⅥA族;p;H2SeO4;
(2)①第4周期ⅣB族,为Ti元素,原子序数为22,价电子排布为3d24s2,故答案为:Ti、3d24s2;
②第4周期ⅦA族,为主族元素,则最外层电子排布式是4s24p5,为Br元素,原子序数为35,故答案为:Br、4s24p5.
点评 本题考查元素周期表的结构与应用,为高频考点,把握原子结构与元素位置的关系为解答的关键,侧重分析与应用能力的考查,副族元素的位置推断为解答的难点,题目难度不大.

练习册系列答案
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目
17.不论以任何比例混合,只要当混合物的质量一定时,混合物完全燃烧后生成的二氧化碳不变的是( )
| A. | 甲苯和乙苯 | B. | 乙烯和丁二烯 | C. | 甲烷和丙烯 | D. | 乙炔和苯 |
14.下列分子式只能表示一种物质的是( )
| A. | C4H9Cl | B. | C2H6O | C. | C2H5Cl | D. | C9H12 |
1.如图表示4-溴环己烯所发生的4个不同反应.其中产物含有2种官能团的反应是( )
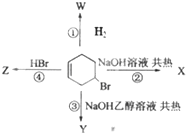

| A. | ① | B. | ①③④ | C. | ② | D. | ①②④ |
11.下列关于有机物的叙述正确的是( )
| A. | 煤经过分馏可得到焦炉气、煤焦油和焦炭 | |
| B. | 甲烷、汽油、酒精都是碳氢化合物,都可作燃料 | |
| C. | 乙烯和聚乙烯都能使溴的四氯化碳溶液褪色 | |
| D. | 蛋白质、淀粉、油脂均能发生水解反应 |
15.X和Y属于短周期元素,X原子的最外层电子数是次外层电子数的一半,Y位于X的前一周期,且最外层只有一个电子,下列的说法正确的是( )
| A. | X可能是第二周期非金属元素 | B. | X可能是第三周期金属元素 | ||
| C. | Y可能与X同主族 | D. | Y可能是金属元素 |
15.1.8g某金属在氯气中燃烧后,质量增加了7.1g,该金属是( )
| A. | Ag | B. | Fe | C. | Al | D. | Na |
 .
.