题目内容
13.下列说法正确的是( )| A. | 第二周期元素从C到F,非金属性逐渐减弱 | |
| B. | 第三周期元素从Na到Cl,原子半径逐渐增大 | |
| C. | HF、HCl、HBr、HI的热稳定性依次逐渐增强 | |
| D. | LiOH、NaOH、KOH的碱性依次逐渐增强 |
分析 A.同周期元素从左到右元素的非金属性逐渐增强;
B.同周期元素从左到右原子半径逐渐减小;
C.元素的非金属性越强,对应的氢化物越稳定;
D.元素的金属性越强,对应的最高价氧化物的碱性越强.
解答 解:A.C到F原子序数逐渐增大,且位于同一周期,非金属性逐渐增强,故A错误;
B.Na到Cl,原子半径逐渐减小,故B错误;
C.非金属性F>Cl>Br>I,元素的非金属性越强,对应的氢化物越稳定,所以HF、HCl、HBr、HI的热稳定性依次逐渐减弱,故C错误;
D.金属性K>Na>Li,元素的金属性越强,对应的最高价氧化物的碱性越强,故D正确.
故选D.
点评 本题考查元素周期律的递变规律,题目难度不大,注意把握元素周期律的递变规律以及元素的性质与对应单质、化合物性质的关系.

练习册系列答案
相关题目
3.下列化学用语的书写正确的是( )
| A. | 二氧化硅晶体的分子式:SiO2 | B. | 乙烯的结构简式:CH2CH2 | ||
| C. | F-离子结构示意图: | D. | 四氯化碳的电子式: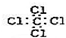 |
4.氟利昂-122的化学式是CF2Cl2,下面关于氟利昂-122的说法正确的是( )
| A. | 属于正四面体的空间结构 | B. | 分子中的碳原子是饱和的 | ||
| C. | 没有同分异构体 | D. | 是甲烷的同系物 |
1.如图表示4-溴环己烯所发生的4个不同反应.其中产物含有2种官能团的反应是( )
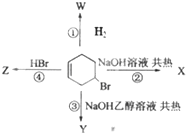

| A. | ① | B. | ①③④ | C. | ② | D. | ①②④ |
5.和氖原子有相同的电子层结构的微粒是( )
| A. | He | B. | K+ | C. | Cl- | D. | Na+ |
2.能影响水的电离平衡,并使溶液中的[H+]>[OH-]的操作是( )
| A. | 向水中投入一小块金属钠 | B. | 将水加热煮沸 | ||
| C. | 向水中通入二氧化碳气体 | D. | 向水中加食盐晶体 |
 ;一种由B、C组成的化合物与AC2互为等电子体,其化学式为N2O.
;一种由B、C组成的化合物与AC2互为等电子体,其化学式为N2O.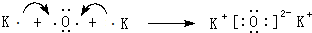 .
.