题目内容
10.工业上用铝土矿(主要成分为Al2O3,杂质为Fe2O3和SiO2)为原料冶炼铝的工艺流程之一为:下列叙述不正确的是( )
| A. | 沉淀甲为SiO2 | |
| B. | 生成沉淀乙的反应为:Fe3++3OH-=Fe(OH)3↓ | |
| C. | 溶液乙中含有AlO2- | |
| D. | 反应③为:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- |
分析 由分离流程可知,SiO2和盐酸不反应,先加过量盐酸,沉淀甲为SiO2,溶液甲为氯化铝和氯化铁的混合液,再加NaOH溶液,生成沉淀乙为Fe(OH)3↓,溶液乙中含NaAlO2,向偏铝酸钠溶液中通入过量的二氧化碳可以生成Al(OH)3沉淀,则沉淀丙为Al(OH)3,Al(OH)3加热分解可以得到氧化铝,电解氧化铝生成Al,以此来解答.
解答 解:由分离流程可知,SiO2和盐酸不反应,先加过量盐酸,沉淀甲为SiO2,溶液甲为氯化铝和氯化铁的混合液,再加NaOH溶液,生成沉淀乙为Fe(OH)3↓,溶液乙中含NaAlO2,向偏铝酸钠溶液中通入过量的二氧化碳可以生成Al(OH)3沉淀,则沉淀丙为Al(OH)3,Al(OH)3加热分解可以得到氧化铝,电解氧化铝生成Al,
A.由上述分析可知,沉淀甲为SiO2,故A正确;
B.氯化铁与NaOH反应生成沉淀乙,离子反应为:Fe3++3OH-=Fe(OH)3↓,故B正确;
C.由上述分析可知,溶液乙中含有AlO2-,故C正确;
D.反应③中二氧化碳过量,生成氢氧化铝和碳酸氢钠,则离子反应为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,故D错误;
故选D.
点评 本题考查物质的分离、提纯的方法及综合应用,为高频考点,把握流程中的反应及混合物分离方法为解答的关键,侧重分析与实验能力的考查,注意试剂过量对反应的影响及试剂的作用,题目难度不大.

练习册系列答案
相关题目
1.如图表示4-溴环己烯所发生的4个不同反应.其中产物含有2种官能团的反应是( )
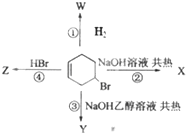

| A. | ① | B. | ①③④ | C. | ② | D. | ①②④ |
18.下列有关物质分离方法的叙述中,不正确的是( )
| A. | 用过滤的方法分离氯化钠溶液和牛奶的混合物 | |
| B. | 用蒸馏的方法将自来水制成蒸馏水 | |
| C. | 用四氯化碳萃取碘水中的碘 | |
| D. | 用加热的方法分离氯化钠和氯化铵固体 |
15.1.8g某金属在氯气中燃烧后,质量增加了7.1g,该金属是( )
| A. | Ag | B. | Fe | C. | Al | D. | Na |
2.能影响水的电离平衡,并使溶液中的[H+]>[OH-]的操作是( )
| A. | 向水中投入一小块金属钠 | B. | 将水加热煮沸 | ||
| C. | 向水中通入二氧化碳气体 | D. | 向水中加食盐晶体 |
19.用加热的方法可分离的物质组是( )
| A. | 碘和NH4Cl固体 | B. | NH4Cl和食盐固体混合物 | ||
| C. | 碳酸氢铵和过氧化钠 | D. | NH4Cl和消石灰固体混合物 |
20.在实验室中,除去Cl2中混有的水蒸汽和HCl气体,选用药品及顺序正确的是( )
| A. | 水、碱石灰(CaO+NaOH) | B. | 饱和食盐水、浓H2SO4 | ||
| C. | 无水CaCl2、饱和食盐水 | D. | 饱和食盐水、碱石灰 |

