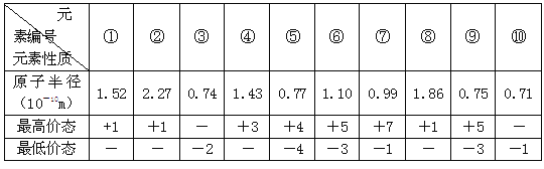
题目内容
【题目】某原电池结构如图所示,下列有关该原电池的说法不正确的是( )
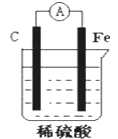
A. 能将化学能转换成电能
B. 电子从碳棒经外电路流向铁棒
C. 碳棒发生还原反应
D. 总反应为Fe+H2SO4= FeSO4+H2↑
【答案】B
【解析】
原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应,据此解答。
A.该装置是原电池,是将化学能转变为电能的装置,故A正确;
B.铁是活泼的金属,铁是负极,碳棒是正极,电子从铁棒沿导线流向碳棒,故B错误;
C.碳棒上氢离子得电子发生还原反应,故C正确;
D.该原电池的电池总反应式为:Fe+H2SO4=FeSO4+H2↑,故D正确;
故答案选B。

 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案【题目】已知:常温下浓度均为0.1 mol·L-1的下列各溶液的pH如下表所示,下列有关说法正确的是( )
溶质 | NaF | NaClO | Na2CO3 |
pH | 7.5 | 9.7 | 11.6 |
A. 在相同温度下,同浓度的三种酸溶液的导电能力顺序:H2CO3<HClO<HF
B. 若将CO2通入0.1 mol·L-1 Na2CO3溶液中至溶液呈中性,则溶液中2c(CO32-)+c(HCO3-)=0.1 mol·L-1(忽略溶液体积变化)
C. 根据上表,水解方程式ClO-+H2O![]() HClO+OH-的平衡常数K≈10-7.6
HClO+OH-的平衡常数K≈10-7.6
D. 向上述NaClO溶液中通过量CO2气体的离子方程式为:2ClO-+CO2+H2O === 2HClO+CO32-
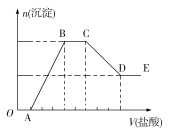
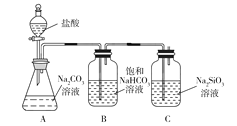
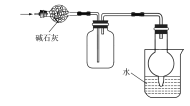
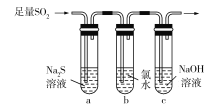
【题目】下列实验图示不能完成实验描述的是
选项 | 实验描述 | 实验图示 |
A | 该实验能验证氧化性: H2O2>Br2>H2SO3 |
|
B | 该实验能够实现比较HCl、H2CO3、H2SiO3酸性的强弱 |
|
C | 该实验装置用于干燥、收集并吸收多余氨气 |
|
D | 该实验能验证SO2的氧化性、还原性 |
|
A. AB. BC. CD. D