题目内容
【题目】某无色溶液W中,可能含有K+、Na+、Mg2+、Al3+、Cu2+、NH4+、OH、Cl、CO32-、AlO2-、SiO32-中的一种或几种,其所含的阴离子的物质的量浓度相等,取一定量该溶液,向其中加入一定物质的量浓度的稀盐酸,产生沉淀的物质的量(n)与加入盐酸的体积(V)的关系如图所示,下列有关说法不正确的是
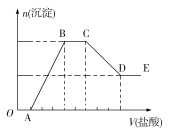
A. 该溶液中至少含有5种离子(不考虑水的电离)
B. B→C分为两个反应阶段,有两个离子反应,且反应过程中有气体生成
C. A点与D点含有同一种元素的离子能反应生成B、C两点含同一种元素的物质
D. 向W溶液中通入B→C产生的气体至过量,产生的沉淀与B点产生的沉淀不同
【答案】D
【解析】
因为该溶液为无色溶液,所以没有Cu2+,根据图像分析可知OA段应该是OH参与反应,所以原溶液中没有Mg2+、Al3+、NH4+,CD段应该是Al(OH)3的溶解,原溶液中含AlO2-,DE段代表有一种物质不溶于酸,只能是硅酸,说明原溶液有SiO32-,假设OA段消耗盐酸为1单位,则溶液中含OH为1单位,因为所含的阴离子的物质的量浓度相等,AlO2-消耗盐酸1单位,SiO32-消耗盐酸则为2单位,BC段说明有CO32-,发生反应为:CO32-+H+=HCO3-, HCO3-+H+=CO2↑+H2O;
A.由分析知,溶液中含4种阴离子,还会含至少一种阳离子,故A正确;
B.B→C段发生CO32-→HCO3-→CO2的过程,故B正确;
C.A点与D点含有同一种元素的离子是AlO2-、Al3+,能反应生成Al(OH)3,离子方程式为Al3++3AlO2-+6H2O=4Al(OH)3↓,故C正确;
D.根据分析B→C产生的CO2,与原溶液中离子反应的先后顺序为OH、AlO2-、SiO32-,CO2+2OH=CO32-+H2O,CO2+2AlO2-+3H2O=2Al(OH)3↓+CO32-,CO2+SiO32-+H2O=H2SiO3↓+CO32-,CO2+CO32-+H2O=2HCO3-,生成沉淀与B点沉淀相同,故D错误;
故答案为D。

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案