题目内容
【题目】元素周期表是学习化学的重要工具,它隐含着许多信息和规律.下表所列是五种短周期的原子半径及主要化合价(已知铍的原子半径为0.089nm).
元素代号 | A | B | C | D | E | F | G |
原子半径/nm | 0.037 | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 | 0.075 |
主要化合价 | +1 | +2 | +3 | +6、-2 | -1 | -2 | +5、-3 |
(1)C元素在元素周期表中的位置是 ______ ;
(2)B的原子结构示意图为 ______ ;
(3)D、E气态氢化物的稳定性强弱顺序为 ______ (填化学式);
(4)上述七种元素的最高价氧化物对应水化物中酸性最强的是 ______ (填化学式);
(5)以C为材料制成的容器不能贮存强碱溶液,用离子方程式表示其原因为: ______ ;
(6)碲(52Te)的某化合物是常用的VCR光盘记录材料之一,可在激光照射下发生化学或物理的性能改变而记录、储存信号.推测碲元素在周期表中的位置,则碲元素及其化合物可能具有的性质为:______ ;
A.单质碲在常温下是固体B.Cl2通入H2Te溶液中不发生反应
C.H2Te不如HI稳定 D.H2TeO4的酸性比H2SO4的弱
【答案】 第三周期第ШA族 ![]() H2S<HCl HClO4 2Al+2OH-+2H2O=2AlO2-+3H2↑ ACD
H2S<HCl HClO4 2Al+2OH-+2H2O=2AlO2-+3H2↑ ACD
【解析】分析:短周期元素中,D、F都有-2价,处于ⅥA族,D有+6价且原子半径D>F,故D为硫、F为氧;E有-1价,原子半径大于氧,故E为Cl;B、C化合价分别为+2、+3,分别处于ⅡA族、ⅢA族,原子半径B>C>硫,故B为Mg、C为Al;A的化合价为+1,处于IA族,原子半径小于氧的,故A为氢;G的化合价为+5、-3,处于VA族,原子半径小于Cl的,则G为N元素,据此解答。
详解:根据以上分析可知A是H、B是Mg、C是Al、D是S、E是Cl、F是O、G是N。则
(1)C为Al元素,在元素周期表中的位置是第三周期第ШA族;
(2)B为Mg元素,原子结构示意图为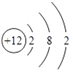 ;
;
(3)由于非金属性S<Cl,非金属性越强,氢化物越稳定,则气态氢化物的稳定性强弱顺序为:H2S<HCl;
(4)非金属性越强,最高价含氧酸的酸性越强,因此上述七种元素的最高价氧化物对应水化物中酸性最强的是HClO4;
(5)以Al为材料制成的容器不能贮存强碱溶液,原因是铝与氢氧化钠溶液反应,方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑;
(6)A.碲元素在周期表中的位置为第五周期第VIA族,单质碲在常温下是固体,A正确;
B.H2Te与H2S性质类似,Cl2通入H2Te溶液中发生氧化还原反应,B错误;
C.非金属性Te<I,则H2Te不如HI稳定,C正确;
D.非金属性Te<S,则H2TeO4的酸性比H2SO4的弱,D正确。答案选ACD。