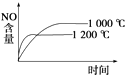
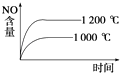
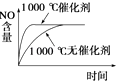
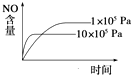题目内容
【题目】恒温下,将amolN2与bmH2的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2(g)+3H2(g) ![]() 2NH3(g)。
2NH3(g)。
(1)若反应进行到某时刻t时,nt(N2)=13mol,nt(NH3)=6mol,计算a的值__________。
(2)反应达平衡时,混合气体的体积为716.8L(标准状况下),其中NH3的含量(体积分数为25%。计算平衡时NH3的物质的量为_________________。
(3)原混合气体与平衡混合气体的总物质的量之比(写最简整数比,下同),n(始):n(平)=______。
(4)原混合气体中,a:b=______________。
(5)达到平衡时,N2和H2的转化率之比,a(N2):a(H2)=_____________。
【答案】 16 8mol 5∶4 2∶3 1∶2
【解析】分析:(1)计算参加反应的氮气的物质的量,结合氨气的物质的量,利用物质的量之比等于化学计量数之比计算a的值;
(2)计算出混合气体总的物质的量,利用体积分数计算氨气的物质的量;
(3)根据三段式解题,结合氨气的体积分数计算b的值,据此计算;
(4)根据(1)、(3)中求出的a、b的值计算;
(5)分别计算出氮气和氢气的转化率,然后计算二者的比值。
详解:(1)物质的量之比等于化学计量数之比,所以(a-13)mol:6mol=1:2,解得a=16;
(2)反应达平衡时,混合气体的物质的量为716.8L÷22.4L/mol=32mol,其中NH3的物质的量为32mol×25%=8mol;
(3) N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
起始量(mol):16 b 0
变化量(mol):4 12 8
平衡量(mol):12 (b-12) 8
平衡时,NH3的含量(体积分数)为25%,所以8mol/[12mol+(b12)mol+8mol]×100%=25%,解得b=24,所以平衡混合气的组成为:氮气12 mol,氢气12 mol,氨气为8 mol,则原混合气体与平衡混合气体的物质的量之比n(始):n(平)=40mol:32mol=5:4;
(4)由(1)知a=16mol,由(3)b=24mol,所以a:b=16mol:24mol=2:3;
(5)由(3)可知,开始是氢气的物质的量为24mol;平衡时参加反应的氮气的物质的量为4mol,参加反应的氢气的物质的量为12mol,所以达到平衡时,N2和H2的转化率之比α(N2):α(H2)=4mol/16mol:12mol/24mol=1:2。

 高效智能课时作业系列答案
高效智能课时作业系列答案【题目】元素周期表是学习化学的重要工具,它隐含着许多信息和规律.下表所列是五种短周期的原子半径及主要化合价(已知铍的原子半径为0.089nm).
元素代号 | A | B | C | D | E | F | G |
原子半径/nm | 0.037 | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 | 0.075 |
主要化合价 | +1 | +2 | +3 | +6、-2 | -1 | -2 | +5、-3 |
(1)C元素在元素周期表中的位置是 ______ ;
(2)B的原子结构示意图为 ______ ;
(3)D、E气态氢化物的稳定性强弱顺序为 ______ (填化学式);
(4)上述七种元素的最高价氧化物对应水化物中酸性最强的是 ______ (填化学式);
(5)以C为材料制成的容器不能贮存强碱溶液,用离子方程式表示其原因为: ______ ;
(6)碲(52Te)的某化合物是常用的VCR光盘记录材料之一,可在激光照射下发生化学或物理的性能改变而记录、储存信号.推测碲元素在周期表中的位置,则碲元素及其化合物可能具有的性质为:______ ;
A.单质碲在常温下是固体B.Cl2通入H2Te溶液中不发生反应
C.H2Te不如HI稳定 D.H2TeO4的酸性比H2SO4的弱