题目内容
12.(1)现有如下列反应:NaOH+HCl=NaCl+H2O根据该反应本质,判断能否设计成原电池,如果不能,说明其原因不能,因为原电池的反应本质是氧化还原反应,此中和反应不是氧化还原反应;.(2)选择适宜的材料和试剂设计一个原电池,以便完成下列反应.Fe+CuSO4═FeSO4+Cu
①画出装置图;
②电极材料和电解质溶液各是什么?
③写出正负电极反应式以及电极总反应式.
分析 (1)NaOH+HCl=NaCl+H2O,为非氧化还原反应不能设计成原电池;
(2)利用反应Fe+CuSO4═FeSO4+Cu设计原电池时,根据反应可知,Fe为负极,则正极可以是活泼性不如Fe的金属如Cu等,也可以是碳棒,电解质溶液应为CuSO4,工作时,正极反应式为Cu2++2e-=Cu,有红色金属析出,负极反应式为Fe-2e-=Fe2+,铁棒逐渐溶解,据此画出原电池装置图,写出电极反应.
解答 解:(1)原电池是将化学能转变为电能的装置,只有氧化还原反应才有电子的转移,而NaOH+HCl=NaCl+H2O为非氧化还原反应,不能设计成原电池,故答案为:不能,因为原电池的反应本质是氧化还原反应,此中和反应不是氧化还原反应;
(2)①利用反应Fe+CuSO4═FeSO4+Cu设计原电池时,根据反应可知,Fe为负极,则正极可以是活泼性不如Fe的金属如Cu等,也可以是碳棒,电解质溶液应为CuSO4,所以装置图为: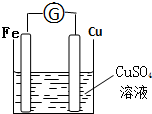 ;
;
②由以上原电池装置图可知,电极材料正极为铜,负极为铁,电解质溶液是硫酸铜;答:电极材料正极为铜,负极为铁,电解质溶液是硫酸铜;
③工作时,正极反应式为Cu2++2e-=Cu,负极反应式为Fe-2e-=Fe2+,电极总反应式:Fe+Cu2+=Fe2++Cu;
答:负极:Fe-2e-=Fe2+;正极:Cu2++2e-=Cu;电极总反应式:Fe+Cu2+=Fe2++Cu.
点评 本题考查原电池的设计和工作原理,题目难度不大,注意原电池的组成特点和反应原理,注意电极反应式的书写方法,试题培养了学生灵活应用所学知识的能力.

练习册系列答案
 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案
相关题目
2.下列有关阿伏加德罗常数(NA)的叙述正确的是( )
| A. | 常温常压下,32克氧气中含有2NA个原子 | |
| B. | 标准状况下,1L己烯完全燃烧后所生成气态产物的分子数为6NA/22.4 | |
| C. | 78g Na2O2晶体中含有的阴离子数目为2NA个 | |
| D. | 1molNa2O2与足量CO2反应转移的电子总数为2NA |
3.将一小块Na投入到足量的CuSO4溶液中,现象描述正确的是( )
| A. | 置换出金属铜 | B. | 产生气体,置换出金属铜 | ||
| C. | 只生成蓝色沉淀 | D. | 产生气体,生成蓝色沉淀 |
20.下列叙述中,正确的是(NA代表阿伏加德罗常数)( )
| A. | 1 mo1 N2和3 mol H2在一定条件下的密闭容器中充分反应,容器内的分子数2NA | |
| B. | 1 mol•L-1 FeCl3溶液中所含Cl-的数目为3NA | |
| C. | 标准状况下,22.4L14CO2与44g14CO2所含分子数均为NA | |
| D. | 标准状况下,16 g O3和O2混合气体中含有的氧原子数为NA |
7.如图是课外活动小组设计的用化学电源使LED灯发光的装置.下列说法错误的是( )
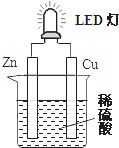

| A. | 铜片表面有气泡生成,且铜片为正极,为电子流入的一极 | |
| B. | 如果将硫酸换成苹果汁,导线中不会有电子流动 | |
| C. | 装置中存在“化学能→电能→光能”的转换 | |
| D. | 如果将锌片换成铁片,电路中的电流方向由铜片经导线流向铁片,铁片发生氧化反应 |
17.下列关于有机物的描述正确的是( )
| A. | 葡萄糖和果糖互为同分异构体,淀粉和纤维素也互为同分异构体 | |
| B. | 淀粉、油脂和蛋白质都能发生水解反应,淀粉水解的最终产物可与新制的Cu(OH)2反应 | |
| C. | 多糖、蛋白质、脂肪和聚丙烯都属于高分子化合物 | |
| D. | 汽油、柴油、植物油、棉、麻、丝、毛完全燃烧只生成CO2和H2O |
16.25℃时,在1.0L浓度均为0.01mol•L-1的某一元酸HA与其钠盐组成的混合溶液中,测得c(Na+)>c(A-),则下列描述中,错误的是( )
| A. | c(A-)+c(HA)=0.02 mol•L-1 | B. | 该溶液的pH<7 | ||
| C. | HA的酸性很弱,A-水解程度较大 | D. | n(A-)+n(OH-)-n(H+)=0.01 mo1 |
 乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4•xH2O)进行的探究性学习
乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4•xH2O)进行的探究性学习