题目内容
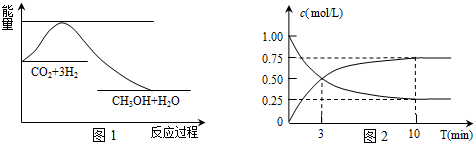
16.25℃时,在1.0L浓度均为0.01mol•L-1的某一元酸HA与其钠盐组成的混合溶液中,测得c(Na+)>c(A-),则下列描述中,错误的是( )| A. | c(A-)+c(HA)=0.02 mol•L-1 | B. | 该溶液的pH<7 | ||
| C. | HA的酸性很弱,A-水解程度较大 | D. | n(A-)+n(OH-)-n(H+)=0.01 mo1 |
分析 A、根据物料守恒确定酸根离子和酸的浓度之和;
B、根据阴阳离子所带电荷相等确定溶液中氢离子浓度和氢氧根离子浓度的相对大小,从而确定溶液的酸碱性;
C、根据混合溶液的酸碱性确定酸的电离程度和酸根离子水解程度的相对大小;
D、根据电荷守恒确定溶液中阴阳离子关系.
解答 解:A、根据溶液中物料守恒得,c(A-)+c(HA)=0.02 mol•L-1,故A正确;
B、混合溶液呈电中性,溶液中阴阳离子所带电荷相等,因为c(Na+)>c(A-),所以溶液中c(H+)<c(OH-),所以pH>7,故B错误;
C、混合溶液是酸和钠盐的混合液,溶液呈碱性,说明酸的电离程度小于酸根离子的水解程度,故C正确;
D、混合溶液呈电中性,溶液中阴阳离子所带电荷相等,n(A-)+n(OH-)=n(Na+)+n(H+),溶液中钠离子不水解,所以n(Na+)=0.01mol/L×1L=0.01mol,所以n(A-)+n(OH-)=0.01mol+n(H+),故D正确;
故选B.
点评 本题考查了弱电解质的电离,根据溶液中电荷守恒、物料守恒来分析解答即可,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.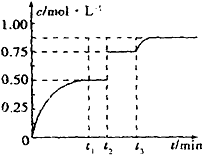 一定温度下,将1mol A和1mol B气体充入2L恒容密闭容器中,发生反应A(g)+B(g)?xC(g)+D(s),t1时达到平衡.在t2、t3时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间的变化如图所示.下列说法正确的是( )
一定温度下,将1mol A和1mol B气体充入2L恒容密闭容器中,发生反应A(g)+B(g)?xC(g)+D(s),t1时达到平衡.在t2、t3时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间的变化如图所示.下列说法正确的是( )
 一定温度下,将1mol A和1mol B气体充入2L恒容密闭容器中,发生反应A(g)+B(g)?xC(g)+D(s),t1时达到平衡.在t2、t3时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间的变化如图所示.下列说法正确的是( )
一定温度下,将1mol A和1mol B气体充入2L恒容密闭容器中,发生反应A(g)+B(g)?xC(g)+D(s),t1时达到平衡.在t2、t3时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间的变化如图所示.下列说法正确的是( )| A. | 反应方程式中的x=1 | |
| B. | t2时刻改变的条件是使用催化剂 | |
| C. | t3时刻改变的条件是移去少量物质D | |
| D. | t1~t3间该反应的平衡常数均为4 |
11.某化学反应2A(g)?B(g)+D(g)在密闭容器中分别在下列四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol•L-1)随反应时间(min)的变化情况如下表:
根据上述数据,完成下列填空:
(1)实验1中,在10~20min时间内,以A的速率表示的平均反应速率为0.02mol/(L•min).
(2)实验2中,A的初始浓度c2=1mol•L-1,反应经20min就达到平衡,可推测实验2中还隐含的条件是使用催化剂.
(3)测得实验2和实验3各组分百分含量相等.设实验3的化学反应速率为v3,实验1的化学反应速率为v1,则v3>v1(填“>”“=”或“<”),且c3=1.2mol•L-1.
(4)实验4和实验1仅起始温度不同.比较实验4和实验1,可推测该反应的正反应是吸热反应(填“吸热”或“放热”),理由是实验4到达平衡时间较短,实验4温度较高,平衡时实验4反应物A的浓度小,平衡正向移动.
(5)实验4中,假定在50min将容器的容积缩小为原来的一半,请在如图中用曲线表示体系中各物质的浓度随时间变化的趋势(曲线上必须标出A、B、D).
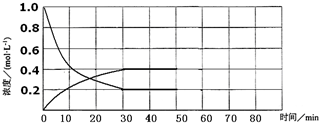
时间 实验序号 | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | c3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | T | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
(1)实验1中,在10~20min时间内,以A的速率表示的平均反应速率为0.02mol/(L•min).
(2)实验2中,A的初始浓度c2=1mol•L-1,反应经20min就达到平衡,可推测实验2中还隐含的条件是使用催化剂.
(3)测得实验2和实验3各组分百分含量相等.设实验3的化学反应速率为v3,实验1的化学反应速率为v1,则v3>v1(填“>”“=”或“<”),且c3=1.2mol•L-1.
(4)实验4和实验1仅起始温度不同.比较实验4和实验1,可推测该反应的正反应是吸热反应(填“吸热”或“放热”),理由是实验4到达平衡时间较短,实验4温度较高,平衡时实验4反应物A的浓度小,平衡正向移动.
(5)实验4中,假定在50min将容器的容积缩小为原来的一半,请在如图中用曲线表示体系中各物质的浓度随时间变化的趋势(曲线上必须标出A、B、D).

1.生产液晶显示器过程中使用的化学清洗剂NF3是一种温室气体,其存储能量的能力是CO2的12000~20000倍,在大气中的寿命可长达740年之久,以下判断正确的是( )
| A. | NF3气体密度比空气小 | B. | 过程N(g)+3F(g)→NF3(g)放出热量 | ||
| C. | NF3属于易燃、高能物质 | D. | NF3室温条件下不稳定 |
8.下列叙述或离子方程式书写正确的是( )
| A. | 将少量二氧化硫通入次氯酸钠溶液中:SO2+H2O+3ClO-═SO42-+Cl-+2HClO | |
| B. | 用氨水溶解氯化银沉淀:Ag++2 NH3•H2O═[Ag(NH3)2]++2H2O | |
| C. | 用惰性电极电解MgCl2溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- | |
| D. | 等物质的量的Ba(OH)2与(NH4)2Fe(SO4)2在溶液中反应:Ba2++2OH-+2NH4++SO42-═BaSO4↓+2NH3•H2O |
6.试管中盛有少量白色固体,可能是铵盐,检验的方法是( )
| A. | 加氢氧化钠溶液,加热,滴入酚酞试剂 | |
| B. | 加氢氧化钠溶液,加热,滴入紫色石蕊试剂 | |
| C. | 加氢氧化钠溶液,加热,将干燥的红色石蕊试纸靠近试管口 | |
| D. | 加氢氧化钠溶液,加热,将湿润的红色石蕊试纸靠近试管口 |