题目内容
17.有人设想合成具有以下结构的烃分子(顶点均为碳原子,氢原子末画出)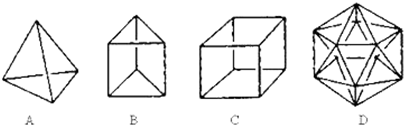
(1)结构D显然是不可能合成的,原因是碳原子不能形成5个共价键
(2)在结构A的每两个碳原子之间插入一个CH2原子团,可以形成金刚烷.则金刚烷的分子式为C10H16
(3)B的一种同分异构体是最简单的芳香烃,能证明该芳香烃中的化学键不是单双键交替排列的事实是ac
a.它的邻位二元取代物只有一种 b.它的对位二元取代物只有一种
c.分子中所有碳碳键的键长均相等 d.能发生取代反应和加成反应
(4)C的二氯代物有3种结构.
分析 (1)碳原子最外层只有4个电子,最多可形成4个共价键;
(2)根据结构可知最多可插入6个CH2原子团,根据C、H原子数判断分子式;
(3)B的一种同分异构体是最简单的芳香烃应为苯,根据苯的结构判断;
(4)根据烃的二氯代物的同分异构体可以采用固定一个氯原子的方法来寻找.
解答 解:(1)碳原子最外层只有4个电子,达到8电子稳定结构时最多可形成4个共价键,不能形成5个共价键,
故答案为:碳原子不能形成5个共价键;
(2)根据结构可知最多可插入6个CH2原子团,则C应为10个,H应为6×2+4=16,所以分子式为C10H16,
故答案为:C10H16;
(3)最简单的芳香烃应为苯,化学键不是单双键交替,分子中所有碳碳键的键长均相等,它的邻位二元取代物只有一种,可证明该结构特征,而无论是否单双键交替,它的对位二元取代物都只有一种,且在一定条件下都能发生取代反应和加成反应,所以证明的为ac,
故答案为:ac;
(4)二氯代物的同分异构体分别是:一条棱、面对角线、体对角线上的两个氢原子被氯原子代替,所以二氯代物的同分异构体有三种,
故答案为:3.
点评 本题考查有机物的结构和性质,题目难度中等,本题注意把握有机物的空间结构和碳原子的成键特点.

练习册系列答案
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案
相关题目
14.下列说法或叙述不正确的是( )
| A. | 蛋白质“溶液”是一种胶体,向该分散系中加入少量的盐(如硫酸铵)能促进蛋白质的溶解 | |
| B. | 饱和(NH4)2SO4溶液能使蛋白质变性 | |
| C. | 用半透膜可除去蛋白质溶液中的NaCl | |
| D. | 用灼烧的方法检验是毛线还是棉线 |
8.改变反应物的用量,下列反应不能用同一个反应方程式表示的是( )
①NaAlO2溶液与CO2反应; ②Si与烧碱溶液反应; ③H2S与NaOH溶液反应;
④Fe与稀硝酸反应; ⑤S在O2中燃烧; ⑥C与O2的反应.
①NaAlO2溶液与CO2反应; ②Si与烧碱溶液反应; ③H2S与NaOH溶液反应;
④Fe与稀硝酸反应; ⑤S在O2中燃烧; ⑥C与O2的反应.
| A. | ①②③⑤ | B. | ①③④ | C. | ①③④⑥ | D. | ①③④⑤⑥ |
5.某铁矿石样品的主要成分为铁的氧化物,还含有少量SiO2.某化学兴趣小组对该铁矿石中铁元素的价态及含量进行如下探究:
(1)探究铁矿石中铁元素的价态
①提出假设:
假设一:该铁矿石中铁元素的价态为+2;
假设二:该铁矿石中铁元素的价态为+3;
假设三:该铁矿石中铁元素的价态为+2和+3.
②设计实验方案:
为了确定该铁矿石中铁元素的价态,甲同学设计了如下实验方案,请你利用限选试剂帮他完成该探究过程.限选试剂:1mol?L-1H2SO4溶液、3%双氧水溶液、2mol?L-1HNO3溶液、0.01mol?L-1高锰酸钾溶液、1mol?L-1NaOH溶液、0.1mol?L-1KI溶液、0.01mol?L-1KSCN溶液、蒸馏水.
③问题讨论:
乙同学设计了如下实验方案:取少量样品于试管中,滴加适量的2mol?L-1HNO3溶液,加热溶解,得到B溶液,取少量B溶液于试管中,向其中滴加几滴0.01mol?L-1KSCN溶液,溶液变红色,说明该铁矿石中铁元素的价态为+3.你认为此结论错误(填“正确”或“错误”),其理由是稀硝酸具有强氧化性,能将样品中+2价的铁氧化为+3价的铁.
(2)探究铁矿石中铁的含量
将2.25g该铁矿石样品经一系列化学处理,制得铁元素全部为Fe2+的待测液250mL;现利用0.02mol?L-1酸性高锰酸钾溶液对铁矿石中铁元素的含量进行测定.
①取25.00mL待测液于锥形瓶中,用已配制的0.02mol?L-1酸性高锰酸钾溶液进行滴定,判断达到滴定终点的方法是滴加最后一滴酸性高锰酸钾溶液时,溶液由浅黄色突然变为红色,且半分钟内不再变为无色,即达到滴定终点.
②重复此滴定操作2~3次,平均消耗酸性高锰酸钾溶液21.50mL,则该铁矿石中铁元素的质量分数为53.5%.
(1)探究铁矿石中铁元素的价态
①提出假设:
假设一:该铁矿石中铁元素的价态为+2;
假设二:该铁矿石中铁元素的价态为+3;
假设三:该铁矿石中铁元素的价态为+2和+3.
②设计实验方案:
为了确定该铁矿石中铁元素的价态,甲同学设计了如下实验方案,请你利用限选试剂帮他完成该探究过程.限选试剂:1mol?L-1H2SO4溶液、3%双氧水溶液、2mol?L-1HNO3溶液、0.01mol?L-1高锰酸钾溶液、1mol?L-1NaOH溶液、0.1mol?L-1KI溶液、0.01mol?L-1KSCN溶液、蒸馏水.
| 实验步骤 | 预期现象及结论 |
| 步骤1:取少量样品于试管中,滴加适量的1mol?L-1H2SO4溶液,加热溶解,得到A溶液 | |
| 步骤2: | 若高锰酸钾溶液紫红色褪去,则样品中含+2价的铁元素 |
| 步骤3: | 若溶液变红色,则样品中含+3价的铁元素 |
乙同学设计了如下实验方案:取少量样品于试管中,滴加适量的2mol?L-1HNO3溶液,加热溶解,得到B溶液,取少量B溶液于试管中,向其中滴加几滴0.01mol?L-1KSCN溶液,溶液变红色,说明该铁矿石中铁元素的价态为+3.你认为此结论错误(填“正确”或“错误”),其理由是稀硝酸具有强氧化性,能将样品中+2价的铁氧化为+3价的铁.
(2)探究铁矿石中铁的含量
将2.25g该铁矿石样品经一系列化学处理,制得铁元素全部为Fe2+的待测液250mL;现利用0.02mol?L-1酸性高锰酸钾溶液对铁矿石中铁元素的含量进行测定.
①取25.00mL待测液于锥形瓶中,用已配制的0.02mol?L-1酸性高锰酸钾溶液进行滴定,判断达到滴定终点的方法是滴加最后一滴酸性高锰酸钾溶液时,溶液由浅黄色突然变为红色,且半分钟内不再变为无色,即达到滴定终点.
②重复此滴定操作2~3次,平均消耗酸性高锰酸钾溶液21.50mL,则该铁矿石中铁元素的质量分数为53.5%.
12.设NA为阿伏加德罗常数的值,标准状况下O2和N2的混合气体m g含有b个分子,则n g该混合气体在相同状况下所占的体积应是( )
| A. | $\frac{22.4nb}{m{N}_{A}}$L | B. | $\frac{22.4mb}{n{N}_{A}}$ L | C. | $\frac{22.4n{N}_{A}}{mb}$ L | D. | $\frac{nb{N}_{A}}{22.4m}$ L |
2.下列有关操作或判断正确的是( )
| A. | 配制一定物质的量浓度的溶液时,定容时俯视刻度线会导致所配溶液浓度偏低 | |
| B. | 用托盘天平称取25.20 g NaCl | |
| C. | 用100 mL的量筒量取5.2 mL的盐酸 | |
| D. | 用浓盐酸配制一定物质的量浓度的稀盐酸,量取浓盐酸时仰视量筒的刻度线读数会导致所配溶液浓度偏高 |
9.向一定浓度的下列物质的澄清溶液中通入过量的CO2气体,最后肯定没有沉淀生成的是( )
①Ca(OH)2 ②Na2CO3 ③CaCl2 ④Ca(ClO)2 ⑤Na2SiO3.
①Ca(OH)2 ②Na2CO3 ③CaCl2 ④Ca(ClO)2 ⑤Na2SiO3.
| A. | ①③④ | B. | ②③④ | C. | ①②③⑤ | D. | ①②③④ |
7.生活中处处存在化学,下列说法不正确的是( )
| A. | 热水瓶胆中的水垢可以用食醋除去 | |
| B. | 福尔马林用于标本的制作是利用了使蛋白质变性的性质 | |
| C. | 含钙、钡、铂等金属元素的物质有绚丽的颜色,可用于制造焰火 | |
| D. | 在清理厕所时洁厕灵和84消毒液不能混用,否则可能发生中毒现象 |
