题目内容
7.写出下列变化的化学方程式,并指出其反应类型:(1)甲烷和氯气在光照下反应(只写其中一个):CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl、取代反应
(2)由乙烯为原料制取氯乙烷:CH2=CH2+HCl$\stackrel{一定条件}{→}$CH3CH2Cl、加成反应
(3)乙烯和溴的四氯化碳溶液的反应:CH2=CH2+Br2→CH2BrCH2Br、加成反应
(4)乙醇和金属钠的反应:2CH3CH2OH+2Na→2CH3CH2ONa+H2↑、置换反应.
分析 (1)甲烷和氯气发生反应,甲烷分子中的氢原子被氯离子取代;
(2)根据烯烃与卤化氢能发生加成反应得到卤代烃;
(3)乙烯含有碳碳不饱和键,能和溴发生加成反应;
(4)根据乙醇与与金属钠反应生成乙醇钠和氢气,断开羟基上的氢氧键来书写.
解答 解:(1)甲烷与氯气在光照下发生取代反应,甲烷分子中的氢原子被氯气分子中的氯原子取代,生成一氯甲烷和氯化氢,CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl,
故答案为:CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl;取代反应;
(2)因烯烃与卤化氢能发生加成反应得到卤代烃,所以用乙烯制备氯乙烷的化学方程式是CH2=CH2+HCl$\stackrel{一定条件}{→}$CH3CH2Cl,
故答案为:CH2=CH2+HCl$\stackrel{一定条件}{→}$CH3CH2Cl;加成反应;
(3)含有不饱和键的有机分子,有机物分子中的不饱和键断裂,断键原子与其它原子或原子团相结合,生成新的化合物,乙烯含有碳碳双键,能和溴反应生成1,2-二溴乙烷,化学方程式为Br2+CH2=CH2→BrCH2CH2Br,
故答案为:CH2=CH2+Br2→CH2BrCH2Br;加成反应;
(4)乙醇与与金属钠反应生成乙醇钠和氢气,断开羟基上的氢氧键,发生置换反应,方程式为2CH3CH2OH+2Na→2CH3CH2ONa+H2↑;
故答案为:2CH3CH2OH+2Na→2CH3CH2ONa+H2↑;置换反应.
点评 本题考查了有机化学反应方程式书写,明确反应原理是解答的关键,题目难度不大.

练习册系列答案
相关题目
18.下列关于热化学反应的描述中正确的是( )
| A. | HCl和NaOH反应的中和热△H=-57.3 kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol | |
| B. | CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的△H=+566.0 kJ/mol | |
| C. | 需要加热才能发生的反应一定是吸热反应 | |
| D. | Ba(OH)2•8H2O与NH4Cl反应的焓变小于0,所以在常温下能自发进行 |
15.下列各组物质发生反应后,只可能生成一种气体产物的是( )
| A. | 木炭在氧气中燃烧 | B. | 铁粉与高温水蒸气反应 | ||
| C. | 碳酸氢铵受热分解 | D. | Na2O2加入氯化铵溶液中 |
2.下列变化不需要破坏化学键的是( )
| A. | HCl气体溶于水 | B. | 碘晶体受热转变成碘蒸气 | ||
| C. | NaCl溶于水 | D. | 加热HI气体使之分解 |
19.下列化学用语正确的是( )
| A. | 氯化氢的电子式为 H+[${\;}_{•}^{•}$$\underset{\stackrel{••}{CI}}{••}$${\;}_{•}^{•}$]- | |
| B. | 乙炔的结构简式(删:可以)写成 CHCH | |
| C. | 镁的原子结构示意图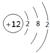 | |
| D. | 碳酸氢钠溶于水电离方程式:NaHCO3═Na++H++CO32- |
17.下列实验的实验目的、图示操作和实验现象均正确的是( )
| A、探究不同催化剂对同一反应速率的影响 | B、探究温度对化学平衡的影响 |
 试剂:淀粉溶液、碘水、 唾液、2mol/L H2SO4溶液 现象:图中左试管溶液颜色一段时间后逐渐变蓝色,右试管溶液颜色迅速变蓝色 | 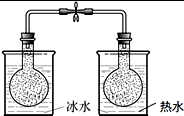 2NO2(g)?N2O4△H<0 试剂:烧瓶中各充入等质量的NO2 现象:一段时间后,右边烧瓶内气体颜色变浅,左边烧瓶内气体颜色变深 |
| C、探究醋酸、碳酸、硼酸的酸性强弱 | D、验证外加电流的阴极保护法 |
 试剂:0.1mol/L醋酸溶液、饱和硼酸 溶液0.1mol/L Na2CO3溶液 现象:图中左试管内液面产生气泡,右试管无明显现象 | 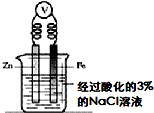 试剂:酸化的3%的NaCl溶液、 铁氰化钾溶液 现象:一段时间后,向烧杯中滴加2滴铁氰化钾溶液,不产生蓝色沉淀 |
| A. | A | B. | B | C. | C | D. | D |

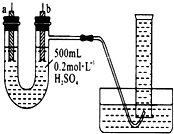 给你提供纯锌、纯铜片、500 mL 0.2 mol/L的H2SO4溶液、导线、1 000 mL量筒.试用如图装置来测定锌和稀硫酸反应时,在某段时间内通过导线的电子的物质的量.
给你提供纯锌、纯铜片、500 mL 0.2 mol/L的H2SO4溶液、导线、1 000 mL量筒.试用如图装置来测定锌和稀硫酸反应时,在某段时间内通过导线的电子的物质的量.