题目内容
12.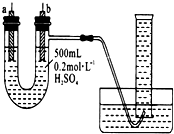 给你提供纯锌、纯铜片、500 mL 0.2 mol/L的H2SO4溶液、导线、1 000 mL量筒.试用如图装置来测定锌和稀硫酸反应时,在某段时间内通过导线的电子的物质的量.
给你提供纯锌、纯铜片、500 mL 0.2 mol/L的H2SO4溶液、导线、1 000 mL量筒.试用如图装置来测定锌和稀硫酸反应时,在某段时间内通过导线的电子的物质的量.(1)如图所示,装置气密性良好,且1 000mL量筒中已充满了水,则开始实验时,首先要用导线把a、b两电极连接起来.
(2)①a电极材料为纯锌片,其电极反应式为Zn-2e-=Zn2+.
②b电极材料为纯铜片,其电极反应式为2H++2e-=H2↑.
(3)当量筒中收集到672 mL气体时(已折算到标准状况下),通过导线的电子的物质的量为0.06mol.
分析 锌、铜、硫酸原电池中,电子转移和产生的氢气量之间存在联系.
(1)根据原电池装置的构成条件:闭合回路、电解质溶液、两个电极以及自发氧化还原反应来回答;
(2)活泼失电子的金属锌做负极,发生氧化反应,铜作正极,发生还原反应;
(3)根据电极反应式进行计算即可.
解答 解:(1)根据图示装置,要想求得电子转移的量,需要设计成锌、铜、硫酸原电池,量取金属锌和硫酸反应产生氢气的体积,根据原电池的构成条件,所以首先要用导线把a、b两电极连接起来,
故答案为:用导线把a、b两电极连接起来;
(2)锌、铜、硫酸原电池中,纯锌片是负极,电极反应:Zn-2e-=Zn2+;铜是正极,该极上电极反应为:2H++2e-=H2↑,
故答案为:纯锌片;Zn-2e-=Zn2+;纯铜片;2H++2e-=H2↑;
(3)正极上电极反应为:2H++2e-=H2↑,当量筒中收集到672ml即标况下0.03mol氢气时,转移电子是0.06mol;故答案为:0.06mol.
点评 本题以实验方式为载体考查学生原电池的构成条件和工作原理知识,注意基本知识的梳理是解题关键,难度中等.

练习册系列答案
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案
相关题目
20.现有容积固定的密闭容器内有反应X(g)+2Y(g)═2Z(g);△H=akJ/mol(a>0),若向密闭容器中通入1molX和2molY,达平衡状态时,吸收热量bkJ;则下列判断正确的是( )
| A. | 当a=b>0时,该反应达到化学平衡状态 | |
| B. | 该反应达到化学平衡状态时,一定有a=b | |
| C. | 当密闭容器内气体密度不再改变时,该反应达到化学平衡状态 | |
| D. | 该反应达到化学平衡状态时,密闭容器内气体的物质的量一定不变 |
17.下列物质中的核磁共振氢谱有6组峰的是( )
| A. |  | B. | 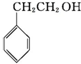 | C. |  | D. | CH3CH2OH |
4.若NA表示阿伏伽德罗常数则下列说法正确的是( )
| A. | 标准状况下,22.4LHF分子中所含的原子数约为2NA | |
| B. | 1mol冰中,平均所含氢键的数目为NA | |
| C. | 在氧化还原反应中,1molH2O2转移的电子数为2NA | |
| D. | 13gCnHn分子中最多含C-C数为1.5NA |
1.能正确表示下列反应的离子方程式为( )
| A. | 向NH4HCO3溶液中加过量NaOH溶液并加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| B. | Fe3+溶液中滴加过量的氨水:Fe3++3OH-=Fe(OH)3↓ | |
| C. | 等体积等物质的量浓度的NaHCO3和Ba(OH)2溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H20 | |
| D. | NaHCO3的水解:HCO3-+H2O=CO32-+H3O+ |
2. 目前,汽车厂商常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO$\stackrel{催化剂}{?}$2CO2+N2.为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究.
目前,汽车厂商常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO$\stackrel{催化剂}{?}$2CO2+N2.为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究.
【资料查阅】
①不同的催化剂对同一反应的催化效率不同;
②使用相同的催化剂,当催化剂质量相等时,催化剂的比表面积对催化效率有影响.
【实验设计】课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验.
(1)完成以下实验设计表(表中不要留空格).
【图象分析与结论】利用气体传感器测定了三组实验中CO浓度随时间变化的曲线图,如下:
(2)计算第Ⅰ组实验中,达平衡时NO的浓度为3.50×10-3mol/L;
(3)由曲线Ⅰ、Ⅱ可知,增大催化剂比表面积,汽车尾气转化速率增大(填“增大”、“减小”、“无影响”).
 目前,汽车厂商常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO$\stackrel{催化剂}{?}$2CO2+N2.为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究.
目前,汽车厂商常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO$\stackrel{催化剂}{?}$2CO2+N2.为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究.【资料查阅】
①不同的催化剂对同一反应的催化效率不同;
②使用相同的催化剂,当催化剂质量相等时,催化剂的比表面积对催化效率有影响.
【实验设计】课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验.
(1)完成以下实验设计表(表中不要留空格).
| 实验编号 | 实验目的 | T/℃ | NO初始浓度 mol/L | CO初始浓度 mol/L | 同种催化剂的比表面积m2/g |
| Ⅰ | 为以下实验作参照 | 280 | 6.50×10-3 | 4.00×10-3 | 80 |
| Ⅱ | 探究催化剂比表面积对尾气转化速率的影响 | 280 | 6.50×10-3 | 4.00×10-3 | 120 |
| Ⅲ | 探究温度对尾气转化速率的影响 | 360 | 6.50×10-3 | 4.00×10-3 | 80 |
(2)计算第Ⅰ组实验中,达平衡时NO的浓度为3.50×10-3mol/L;
(3)由曲线Ⅰ、Ⅱ可知,增大催化剂比表面积,汽车尾气转化速率增大(填“增大”、“减小”、“无影响”).
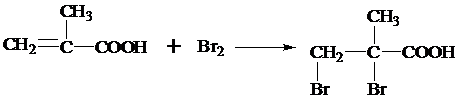 ,反应类型为加成反应.
,反应类型为加成反应.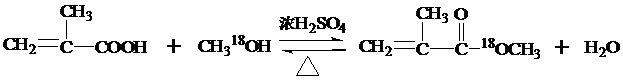 ,该酯化反应生成的产物在一定条件下可以发生加聚反应得到有机玻璃,有机玻璃的结构简式为
,该酯化反应生成的产物在一定条件下可以发生加聚反应得到有机玻璃,有机玻璃的结构简式为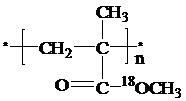 .
.