题目内容
16.欲用98%的浓硫酸(ρ=1.84g•cm-3)配制浓度为1mol•L-1的稀硫酸480mL.回答下列问题:
(1)用量筒量取所需浓硫酸的体积为27.2mL.
(2)从下列用品中选出实验所需要的仪器ADEI(填序号).
A、1000mL烧杯 B、100mL烧杯 C、10mL量筒
D、50mL量筒 E、500mL容量瓶 F、1000mL容量瓶
G、广口瓶 H、托盘天平 I、玻璃棒
除选用上述仪器外,尚缺少的必要仪器或用品是胶头滴管.
(3)下列情况中,会使所配溶液浓度偏高的是CG(填序号).
A.用量筒量取时发现量筒不干净,用水洗净后量取的体积
B.将浓硫酸沿烧杯内壁慢慢注入盛水的烧杯中,并不断搅拌,若搅拌过程中有液体溅出
C.在转入容量瓶前烧杯中的液体没有冷却到室温
D.洗涤烧杯2~3次,洗涤液没有转入容量瓶
E.定容时仰视液面.
G.用量筒量取时仰视液面
F.加蒸馏水时,不慎超过了刻度线
H.容量瓶使用前内壁沾有水珠.
分析 (1)配制480mL的溶液,需要选用500mL的容量瓶,浓H2SO4的物质的量浓度c=$\frac{1000ρw}{M}$,再根据溶液稀释前后物质的量不变计算所需浓硫酸的体积;
(2)根据实验操作的步骤以及每步操作需要仪器确定反应所需仪器,注意量取浓硫酸的体积,选择与量筒的规格最接近的量筒;
(3)根据c=$\frac{n}{V}$分析:若n比理论值小,或V比理论值大时,都会使所配溶液浓度偏小;若n比理论值大,或V比理论值小时,都会使所配溶液浓度偏大.
解答 解:(1)该浓H2SO4的物质的量浓度为:c=$\frac{1000×1.84×98%}{98}$mol/L=18.4mol/L,配制480mL的溶液,需要选用500mL的容量瓶,实际上配制的是500mL 1mol/L的硫酸溶液,根据稀释定律,稀释前后溶质的物质的量不变,来计算浓硫酸的体积,设浓硫酸的体积为xmL,所以xmL×18.4mol/L=500mL×1mol/L,解得:x≈27.2,
故答案为:27.2;
(2)配制步骤有量取、稀释、移液、洗涤、定容、摇匀等操作,用50mL量筒量取(D)(用到胶头滴管)称量,在烧杯(A)中稀释,并用玻璃棒(I)搅拌,冷却后转移到500mL容量瓶(E)中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,需要使用的仪器有:A、1000mL烧杯、I、玻璃棒、D、50mL量筒、E、500mL容量瓶、除选用上述仪器外,尚缺少的必要仪器或用品是:胶头滴管,
故选:ADEI;胶头滴管;
(3)A.用量筒量取时发现量筒不干净,用水洗净后量取的体积,浓硫酸被水稀释,导致浓硫酸的浓度偏低,配制的溶液浓度偏低,故A错误;
B.将浓硫酸沿烧杯内壁慢慢注入盛水的烧杯中,并不断搅拌,若搅拌过程中有液体溅出,溶质的物质的量减少,配制的溶液浓度偏低,故B错误;
C.在转入容量瓶前烧杯中的液体没有冷却到室温,会导致冷却后溶液体积偏小,故浓度偏高,故C正确;
D.洗涤烧杯2~3次,洗涤液没有转入容量瓶,溶质的物质的量减少,配制的溶液浓度偏低,故D错误;
E.定容时仰视液面,溶液的体积偏大,浓度偏小,故E错误;
G.用量筒量取时仰视液面,量取的浓硫酸体积偏大,溶质偏多,故浓度偏高,故G正确;
F.加蒸馏水时,不慎超过了刻度线,溶液的体积偏大,配制的溶液浓度偏低,故F错误;
H.容量瓶使用前内壁沾有水珠,对配制溶液中溶质的物质的量及最终溶液体积都没有影响,配制的溶液浓度无影响,故H错误;
故选CG.
点评 本题考查了配制一定物质的量浓度的溶液的方法,题目难度中等,侧重考查逻辑思维能力和严谨的规范实验操作能力,该题的难点在于误差分析,注意明确误差分析的方法.

 阅读快车系列答案
阅读快车系列答案| A. | 硫化亚铁溶于稀硝酸中:FeS+2H+═Fe2++H2S↑ | |
| B. | 含等物质的量的KHCO3和Ba(OH)2溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H2O | |
| C. | 少量CO2通入硅酸钠溶液中:SiO32-+2CO2+2H2O═H2SiO3↓+2HCO3- | |
| D. | 硫化钠水溶液呈碱性:S2-+2H2O?H2S+2OH- |
| A. | 标准状况下,22.4LHF分子中所含的原子数约为2NA | |
| B. | 1mol冰中,平均所含氢键的数目为NA | |
| C. | 在氧化还原反应中,1molH2O2转移的电子数为2NA | |
| D. | 13gCnHn分子中最多含C-C数为1.5NA |
| A. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- | |
| C. | 加入硝酸银,产生白色沉淀,再加稀硝酸,沉淀不溶解,则溶液中一定有Cl- | |
| D. | 加入KSCN,溶液变血红色,则溶液中一定有Fe2+ |
| A. | 向NH4HCO3溶液中加过量NaOH溶液并加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| B. | Fe3+溶液中滴加过量的氨水:Fe3++3OH-=Fe(OH)3↓ | |
| C. | 等体积等物质的量浓度的NaHCO3和Ba(OH)2溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H20 | |
| D. | NaHCO3的水解:HCO3-+H2O=CO32-+H3O+ |
| MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5 min |
| 块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30min |
(2)实验结果表明,催化剂的催化效果与催化剂的颗粒大小有关.
(3)某同学在10mL H2O2 溶液中加入一定量的二氧化锰,放出气体的体积(标准状况)与反应时间的关系如图1所示,则A、B、C三点所表示的即时反应速率最慢的是C.
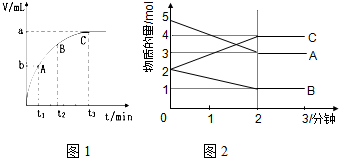
Ⅱ.某反应在体积为5L的恒容密闭容器中进行,在0-3分钟内各物质的量的变化情况如图2所示(A,B,C均为气体,且A气体有颜色).
(4)该反应的化学方程式为2A+B?2C.
(5)反应开始至2分钟时,B的平均反应速率为0.1mol/(L•min).
(6)能说明该反应已达到平衡状态的是cd
a.v(A)=2v(B) b.容器内各物质的物质的量相等
c.v烂(A)=v正(C) d.容器内气体的颜色保持不变
(7)由图求得平衡时A的转化率为40%.

| A. | X、Y、Z元素分别为N、P、O | |
| B. | 白格中都是主族元素,灰格中都是副族元素 | |
| C. | 原子半径:Z>X>Y | |
| D. | X、Y、Z的气态氢化物中最稳定的是:X的氢化物 |