题目内容
【题目】已知某粗盐样品含有Na2SO4、MgCl2、CaCl2等杂质。实验室提纯流程如下:
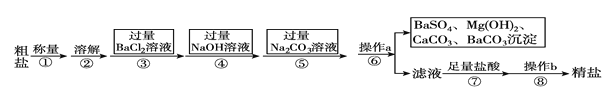
(1)操作a的名称为________,在操作b中玻璃棒的作用是_____________________。
(2)进行步骤③后,判断BaCl2过量的方法是______________________________(写出步骤、现象)。
(3)步骤⑦中能用稀硫酸代替稀盐酸吗?________(填“能”或“不能”),原因是_____________。
(4)某氯化钾样品中含杂质硫酸钾,为了除去硫酸钾,要做以下实验:
A.向滤液中滴加稀盐酸,边滴边振荡至不再产生气体
B.将氯化钾样品溶于适量蒸馏水,配成溶液
C.过滤,将白色沉淀滤出
D.向溶液中加入过量碳酸钾溶液,边滴边振荡至不再产生白色沉淀
E.向溶液中加入过量氯化钡溶液,边滴边振荡至不再产生沉淀
F.将滤液蒸干,得到晶体
①正确的实验操作顺序为______________(填写序号)。
②进行F操作时用到的仪器主要有____________________________________。
【答案】过滤 搅拌,使滤液受热均匀,防止液体飞溅 取少量上层清液于试管中,滴入Na2SO4溶液,若有白色沉淀产生,则Bacl2过量 不能 引入硫酸根杂质离子 BEDCAF 酒精灯、三脚架(或带铁圈的铁架台)、蒸发皿、玻璃棒、坩埚钳
【解析】
实验流程为:粗盐样品含有Na2SO4、MgCl2、CaCl2等杂质,加入过量的氯化钡,可以将硫酸根离子除去,但是会引入钡离子杂质离子,加入过量氢氧化钠溶液的目的是除去氯化镁,加入过量的碳酸钠溶液的目的除去杂质CaCl2和加入的过量试剂BaCl2,过滤,将得到的沉淀全部滤出,得到的滤液是含有氯化钠、碳酸钠、氢氧化钠等的混合物,加入足量的盐酸,可以除去碳酸根离子、氢氧根离子等杂质离子,最后即可获得较为纯净的氯化钠。
(1)实现固体和液体的分离的步骤a是过滤,操作b是对氯化钠溶液蒸发结晶获得氯化钠晶体的过程,此时玻璃棒的作用是:搅拌,使滤液受热均匀,防止液体飞溅,故答案为:过滤;搅拌,使滤液受热均匀,防止液体飞溅;
(2)过量的氯化钡会将全部的硫酸根离子沉淀完毕,只要是氯化钡剩余,则氯化钡会与硫酸钠反应出现白色沉淀,所以判断BaCl2已过量的方法是取少量上层清液于试管中,滴入Na2SO4溶液,若有白色沉淀产生,则Bacl2过量,故答案为:取少量上层清液于试管中,滴入Na2SO4溶液,若有白色沉淀产生,则BaCl2过量;
(3)加入过量的碳酸钠溶液的目的除去杂质CaCl2和加入的过量试剂BaCl2,加入足量的盐酸,可以除去碳酸根离子、氢氧根离子等杂质离子,最后即可获得较为纯净的氯化钠,若加入足量的硫酸,则会在氯化钠中引入硫酸根杂质离子,故答案为:不能;引入硫酸根杂质离子;
(4)①样品溶于水配制的溶液中含有KCl、K2SO4,其中SO42-为杂质,先加入过量的 BaCl2溶液,除去硫酸根离子,反应方程式为:SO42-+Ba2+=BaSO4↓,得到固体A为:BaSO4,滤液B中含有KCl、过量的BaCl2,向滤液中加入过量K2CO3溶液,除去过量的Ba2+离子,得到固体为BaCO3,滤液中溶质为K2CO3和KCl,然后向溶液中加入过量HCl溶液,除去杂质碳酸根离子,发生反应:CO32-+2H+=H2O+CO2↑,则气体为CO2,然后蒸发溶液,溶液中HCl挥发,最终可得到KCl晶体,故答案为:BEDCAF;
②F操作为蒸发,用到的仪器有酒精灯、三脚架(或带铁圈的铁架台)、蒸发皿、玻璃棒、坩埚钳,故答案为:酒精灯、三脚架(或带铁圈的铁架台)、蒸发皿、玻璃棒、坩埚钳。

【题目】C1O2是常用的自来水消毒剂。
I.已知实验室可用亚氯酸钠固体与氯气反应制备ClO2:2NaClO2+C12 =2C1O2+2NaCl,装置如下图所示:

(1)圆底烧瓶内发生反应的化学方程式是:__________。
(2)已知常温常压下,ClO2和Cl2是气体,在下列溶剂中溶解性如下表所示:
ClO2 | Cl2 | |
水 | 极易溶于水 | 溶 |
CCl4 | 难溶 | 溶 |
B、C、E装置中的试剂依次是_________(填序号)。
a.NaOH溶液 b.浓硫酸 c.饱和食盐水 d.CCl4 e.饱和石灰水
II.使用C1O2在给自来水消毒的过程中会产生有害的副产物亚氯酸根(ClO2-),可用Fe2+将其去除。已知ClO2-与Fe2+在pH=5~7的条件下能快速反应,最终形成红褐色沉淀,而ClO2-则被还原成Cl-。
(3)Fe2+消除ClO2-的离子方程式为_______。
(4)实际向自来水中加入Fe2+的量要高于理论值,原因是(结合离子方程式解释)___________。