题目内容
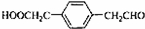
12.化合物Ⅰ(C11H12O3)是制备液晶材料的中间体之一,其分子中含有醛基和酯基.Ⅰ可以用E 和H在一定条件下合成: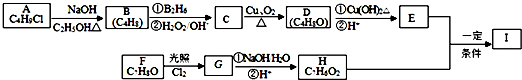
已知:①A的核磁共振氢谱表明其只有一种化学环境的氢;
②RCH=CH2$→_{②H_{2}O_{2}/OH-}^{①B_{2}H_{6}}$RCH2CH2OH
③化合物F苯环上的一氯代物只有两种;
④通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基.
(1)A的化学名称为2-甲基-2-氯丙烷;
(2)D的结构简式为(CH3)2CH2CHO;
(3)I的结构简式为
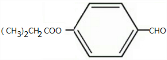 ;
;(4)写出下列反应的类型:A→B:消去;C→D:氧化
(5)F生成G的化学方程式为:
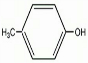 +Cl2$\stackrel{光照}{→}$
+Cl2$\stackrel{光照}{→}$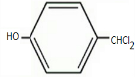 +2HCl;
+2HCl;(6)I的同系物J比I相对分子质量小14,J能同时满足如下条件:①苯环上只有两个取代基,②能发生银镜反应,③能和饱和NaHCO3溶液反应放出CO2;符合上述条件的同分异构体共有18种(不考虑立体异构).若J的一个同分异构体发生银镜反应并酸化后核磁共振氢谱为三组峰,且峰面积比为2:2:1,写出J的这种同分异构体的结构简式
 .
.
分析 A中不含不饱和键,A的核磁共振氢谱表明其只有一种化学环境的氢,则A的结构简式为(CH3)3CCl,A和NaOH的醇溶液发生消去反应生成B,B结构简式为(CH3)2CH=CH2,B发生加成反应生成C,C结构简式为(CH3)2CH2CH2OH,C在Cu作催化剂条件下发生氧化反应生成D,D结构简式为(CH3)2CH2CHO,D和新制氢氧化铜悬浊液发生氧化反应然后酸化得到E,E结构简式为(CH3)2CH2COOH;化合物F苯环上的一氯代物只有两种,则F结构简式为 ,对甲基苯酚和氯气发生取代反应生成G,G发生取代反应生成H,结合题给信息、G和H分子式知,H中含有醛基,则F中甲基上氢原子被氯原子取代,G结构简式为
,对甲基苯酚和氯气发生取代反应生成G,G发生取代反应生成H,结合题给信息、G和H分子式知,H中含有醛基,则F中甲基上氢原子被氯原子取代,G结构简式为 ,H结构简式为
,H结构简式为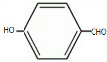 ,E和H发生酯化反应生成I,I结构简式为
,E和H发生酯化反应生成I,I结构简式为 ,据此分析解答.
,据此分析解答.
解答 解:A中不含不饱和键,A的核磁共振氢谱表明其只有一种化学环境的氢,则A的结构简式为(CH3)3CCl,A和NaOH的醇溶液发生消去反应生成B,B结构简式为(CH3)2CH=CH2,B发生加成反应生成C,C结构简式为(CH3)2CH2CH2OH,C在Cu作催化剂条件下发生氧化反应生成D,D结构简式为(CH3)2CH2CHO,D和新制氢氧化铜悬浊液发生氧化反应然后酸化得到E,E结构简式为(CH3)2CH2COOH;
化合物F苯环上的一氯代物只有两种,则F结构简式为 ,对甲基苯酚和氯气发生取代反应生成G,G发生取代反应生成H,结合题给信息、GH分子式知,H中含有醛基,则F中甲基上氢原子被氯原子取代,G结构简式为
,对甲基苯酚和氯气发生取代反应生成G,G发生取代反应生成H,结合题给信息、GH分子式知,H中含有醛基,则F中甲基上氢原子被氯原子取代,G结构简式为 ,H结构简式为
,H结构简式为 ,E和H发生酯化反应生成I,I结构简式为
,E和H发生酯化反应生成I,I结构简式为 ,
,
(1)通过以上分析知,A的结构简式为(CH3)3CCl,A的化学名称为2-甲基-2-氯丙烷,
故答案为:2-甲基-2-氯丙烷;
(2)通过以上分析知,D结构简式为(CH3)2CH2CHO,
故答案为:(CH3)2CH2CHO;
(3)I结构简式为 ,
,
故答案为: ;
;
(4)通过以上分析知,A→B的反应类型为消去,C→D的反应类型为氧化,
故答案为:消去;氧化;
(5)F结构简式为 ,G结构简式为
,G结构简式为 ,F发生取代反应生成G,反应方程式为
,F发生取代反应生成G,反应方程式为 +Cl2$\stackrel{光照}{→}$
+Cl2$\stackrel{光照}{→}$ +2HCl,
+2HCl,
故答案为: +Cl2$\stackrel{光照}{→}$
+Cl2$\stackrel{光照}{→}$ +2HCl;
+2HCl;
(6)I( )的同系物J比I相对分子质量小14,J比I少一个-CH2-原子团,J的同分异构体中能同时满足如下条件:①苯环上只有两个取代基;②既能发生银镜反应,又能与饱和NaHCO3溶液反应放出CO2,则J的同分异构体含有-CHO、-COOH,结合①可知2个不同的取代基处于对位,侧链为-CHO、-CH2CH2COOH,侧链为-CH2CHO、-CH2COOH,侧链为-CH2CH2CHO、-COOH,侧链为-CHO、-CH(CH3)COOH,侧链为-CH(CH3)CHO、-COOH,侧链为-CH3、-CH(CHO)COOH,对应的结构简式为:
)的同系物J比I相对分子质量小14,J比I少一个-CH2-原子团,J的同分异构体中能同时满足如下条件:①苯环上只有两个取代基;②既能发生银镜反应,又能与饱和NaHCO3溶液反应放出CO2,则J的同分异构体含有-CHO、-COOH,结合①可知2个不同的取代基处于对位,侧链为-CHO、-CH2CH2COOH,侧链为-CH2CHO、-CH2COOH,侧链为-CH2CH2CHO、-COOH,侧链为-CHO、-CH(CH3)COOH,侧链为-CH(CH3)CHO、-COOH,侧链为-CH3、-CH(CHO)COOH,对应的结构简式为: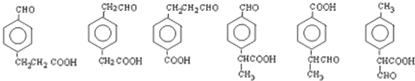 ,每种结构还都有邻位和间位的,故符合条件的同分异构体有18种,J的一个同分异构体发生银镜反应并酸化后核磁共振氢谱为三组峰,且峰面积比为2:2:1,则J的这种同分异构体的结构简式为
,每种结构还都有邻位和间位的,故符合条件的同分异构体有18种,J的一个同分异构体发生银镜反应并酸化后核磁共振氢谱为三组峰,且峰面积比为2:2:1,则J的这种同分异构体的结构简式为 ,
,
故答案为:18; .
.
点评 本题考查有机物推断,侧重考查学生分析推断能力,以A、F结合题给信息为突破口采用正向分析的方法进行推断,结合反应条件判断有机物结构,难点是同分异构体种类判断,题目难度中等.

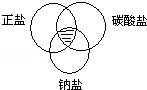 符合图中阴影部分的物质是( )
符合图中阴影部分的物质是( )| A. | Na2CO3 | B. | BaSO4 | C. | MgCl2 | D. | NaHCO3 |
| A. | 第三周期ⅥB族;p区 | B. | 第三周期ⅢB族;ds区 | ||
| C. | 第四周期ⅥB族;d区 | D. | 第四周期ⅢB族;f区 |
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)计算5s时NO2的物质的量浓度(要求写出计算过程)
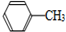 +2KMnO4$\stackrel{△}{→}$
+2KMnO4$\stackrel{△}{→}$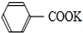 +KOH+2MnO2↓+H2O
+KOH+2MnO2↓+H2O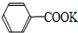 +HCl→
+HCl→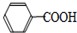 +KCl
+KCl甲苯和KMnO4溶液在100℃反应一段时间后停止反应,分离出苯甲酸和回收未反应的甲苯流程如下

已知:苯甲酸熔点122.4℃,在25℃和95℃时溶解度分别为0.3g和6.9g;下列说法正确的是( )
| A. | 上述反应原理的两个反应都是氧化还原反应 | |
| B. | 操作Ⅰ是蒸馏,操作Ⅱ是分液 | |
| C. | 无色液体A是甲苯,白色固体B主要成分是苯甲酸 | |
| D. | 无色液体A是苯甲酸,白色固体B主要成分是甲苯 |
| A. | 该元素在元素周期表中一定处于ⅦA族 | |
| B. | 该元素可能是氟元素 | |
| C. | 该元素的某种化合物可能具有漂白性 | |
| D. | 该元素的单质没有还原性 |

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(2)NaClO3的作用是将浸出液中的Fe2+氧化成Fe3+,产物中氯元素处于最低化合价.该反应的离子方程式为ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O.
(3)萃取剂对金属离子的萃取率与pH的关系如图2所示.滤液Ⅱ中加入萃取剂的作用是除去溶液中的Mn2+;使用萃取
剂适宜的pH是B.
A.接近2.0 B.接近3.0 C.接近5.0
(4)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀.已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10.当加入过量NaF后,所得滤液$\frac{c(M{g}^{2+})}{c(C{a}^{2+})}$=0.7.
| A. | 30mL | B. | 60mL | C. | 90mL | D. | 120mL |
| A. | 标准状况下,2.24 L Cl2与足量的稀NaOH溶液反应,转移电子总数为0.2NA | |
| B. | 1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 | |
| C. | 欲配制1.00 L 1.00 mol•L-1的NaCl溶液,可将58.5 g NaCl溶于1.00 L水中 | |
| D. | 标准状况下,0.1NA的SO3的体积约为2.24 L |