题目内容
3.已知某元素+3价离子的电子排布式为:1s22s22p63s23p63d3,该元素在周期表中的位置和区是( )| A. | 第三周期ⅥB族;p区 | B. | 第三周期ⅢB族;ds区 | ||
| C. | 第四周期ⅥB族;d区 | D. | 第四周期ⅢB族;f区 |
分析 某+3价离子的电子排布式为1s22s22p63s23p63d3,其原子核外电子数为21+3=24,为Cr元素,原子核外排布式为1s22s22p63s23p63d5s1,据此判断.
解答 解:某+3价离子的电子排布式为1s22s22p63s23p63d3,其原子核外电子数为21+3=24,为Cr元素,原子核外排布式为1s22s22p63s23p63d5s1,处于周期表中第4周期第VIB族,属于d区;
故选C.
点评 本题考查原子结构与位置关系、核外电子排布规律等,难度不大,注意基础知识的理解掌握.

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目
13.下列化学反应的离子方程式正确的是( )
| A. | 用小苏打(NaHCO3)治疗胃酸过多:HCO3-+H+═CO2↑+H2O | |
| B. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-═BaSO4↓+H2O | |
| C. | 碳酸钠溶液与石灰乳的反应:CO32-+Ca2+═CaCO3↓ | |
| D. | 向Ba(OH)2溶液中加入少量的NaHSO4溶液2 H++SO42-+Ba2++2OH-=BaSO4↓+SO42-+2H2O |
14.一定温度下,反应2NO2(g)?2NO(g)+O2(g)在密闭容器中进行,能说明该反应达到平衡状态的是( )
| A. | 单位时间内生成n molO2 的同时,生成2n mol NO | |
| B. | 混合气体的密度不再改变 | |
| C. | 混合气体的平均相对分子质量不再改变 | |
| D. | 用NO2、NO、O2 的物质的量浓度变化表示的反应速率的比为2:2:1 |
8.向含2mol NaOH、1mol Ba(OH)2、2mol Na[Al(OH)4]的混合溶液中慢慢通入CO2,则通入CO2的量和生成沉淀的量的关系不正确的是( )
| 选项 | A | B | C | D |
| n(CO2)(mol) | 2 | 3 | 4 | 6 |
| n(沉淀)(mol) | 1 | 2 | 3 | 2 |
| A. | A | B. | B | C. | C | D. | D |
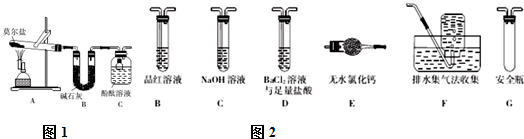
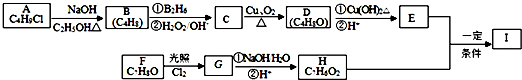
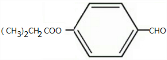 ;
; +Cl2$\stackrel{光照}{→}$
+Cl2$\stackrel{光照}{→}$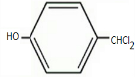 +2HCl;
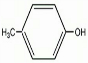
+2HCl;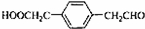 .
.