题目内容
20.将一定量的NO和足量O2投入2L恒容密闭容器内,800℃时只发生的化学反应2NO(g)+O2(g)?2NO2(g),n(NO)随时间变化如下表:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)计算5s时NO2的物质的量浓度(要求写出计算过程)
分析 (1)从0~2s内参加反应NO为(0.02-0.008)mol=0.012mol,根据v=$\frac{△c}{△t}$计算v(NO);
(2)设转化的NOmol,则:
2NO(g)+O2(g) 2NO2(g)
2NO2(g)
开始(mol):0.02 0
变化(mol):x x
5s时(mol):0.007 x
据题意得:x=0.02-0.007=0.013 mol,进而计算二氧化氮的浓度.
解答 解:(1)从0~2s内参加反应NO为(0.02-0.00)mol=0.012mol,则v(NO)=$\frac{\frac{0.012mol}{2L}}{2s}$=0.003 mol/(L•s),故答案为:0.003 mol/(L•s);
(2)设转化的NOmol,则:
NO(g)+O2(g) 2NO2(g)
2NO2(g)
开始(mol):0.02 0
变化(mol):x x
5s时(mol):0.007 x
据题意得:x=0.02-0.007=0.013
c(NO2)=0.013 mol÷2L=0.0065mol/L
答:5s时NO2的物质的量浓度为0.0065mol/L.
点评 本题考查化学平衡计算,比较基础,理解掌握三段式解题法在化学平衡计算中应用.

练习册系列答案
相关题目
10.下列第ⅦA族元素中,非金属性最强的是( )
| A. | 氟 | B. | 氯 | C. | 溴 | D. | 碘 |
8.向含2mol NaOH、1mol Ba(OH)2、2mol Na[Al(OH)4]的混合溶液中慢慢通入CO2,则通入CO2的量和生成沉淀的量的关系不正确的是( )
| 选项 | A | B | C | D |
| n(CO2)(mol) | 2 | 3 | 4 | 6 |
| n(沉淀)(mol) | 1 | 2 | 3 | 2 |
| A. | A | B. | B | C. | C | D. | D |
5.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 1mol Cl2与过量的铁反应,转移2NA个电子 | |
| B. | 1mol ${\;}_{92}^{235}$U核素含有235NA个中子 | |
| C. | 1mol N2与3mol H2混合充分反应,转移的电子数目为6NA | |
| D. | 常温下,0.1mol/L的NH4NO3溶液中氮原子数为0.2NA |
9.氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中反应制得:
①3SiO2+6C+2N2$\frac{\underline{\;高温\;}}{\;}$Si3N4+6CO,也可由SiCl4的蒸汽和NH3反应制取:
②3SiCl4+4NH3$\frac{\underline{\;高温\;}}{\;}$Si3N4+12HCl.则下列叙述正确的是( )
①3SiO2+6C+2N2$\frac{\underline{\;高温\;}}{\;}$Si3N4+6CO,也可由SiCl4的蒸汽和NH3反应制取:
②3SiCl4+4NH3$\frac{\underline{\;高温\;}}{\;}$Si3N4+12HCl.则下列叙述正确的是( )
| A. | 反应②属于离子反应 | |
| B. | 若制取等量的Si3N4,则反应①②转移电子数目可能相等 | |
| C. | 反应①的氧化剂是SiO2 | |
| D. | 反应①中氧化产物与还原产物物质的量之比为6:1 |
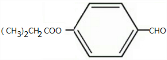 ;
;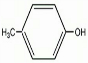 +Cl2$\stackrel{光照}{→}$
+Cl2$\stackrel{光照}{→}$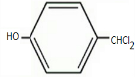 +2HCl;
+2HCl;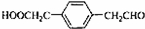 .
.